题目内容
一种新型的烟气脱硝技术(除去烟气中的NOX)的有关反应方程式如下:
4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1;
6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H=-1807.0kJ?mol-1;
6NO2(g)+8NH3(g)?7N2(g)+12H2O(g)△H=-2659.9kJ?mol-1;
NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线如图1.
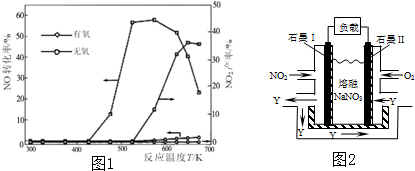
①由图1可以看出,脱硝工艺流程应在 (填“有氧”或“无氧”)条件下进行.
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是 、 .
③NO2也可用尿素[CO(NH2)2]还原,写出尿素与NO2反应的化学方程式 .
④NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 若生成1mol Y,则需要消耗标准状况下氧气的体积为 L.
4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1;
6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H=-1807.0kJ?mol-1;
6NO2(g)+8NH3(g)?7N2(g)+12H2O(g)△H=-2659.9kJ?mol-1;
NO和NH3在Ag2O催化剂表面的反应活性随温度的变化曲线如图1.

①由图1可以看出,脱硝工艺流程应在
②随着反应温度的进一步升高,在有氧的条件下NO的转化率明显下降的可能原因是
③NO2也可用尿素[CO(NH2)2]还原,写出尿素与NO2反应的化学方程式
④NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
考点:化学平衡的影响因素,原电池和电解池的工作原理,化学平衡的调控作用
专题:基本概念与基本理论
分析:①从图上可知,有氧情况下,NO转化率高;
②反应4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化;
③据原子守恒和电子守恒书写;
④氧气在Ⅱ电极上发生氧化反应,电极Ⅰ上发生还原反应,NO2被氧化生成的氧化物只能是N2O5,据电子守恒求需要氧气的体积.
②反应4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化;
③据原子守恒和电子守恒书写;
④氧气在Ⅱ电极上发生氧化反应,电极Ⅰ上发生还原反应,NO2被氧化生成的氧化物只能是N2O5,据电子守恒求需要氧气的体积.
解答:
解:①从图上可知,有氧情况下,NO转化率高,故答案为:有氧;
②反应4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,
故答案为:温度升高,发生了副反应:4NH3+5O2═4NO+6H2O;温度升高,NOx和NH3反应的化学平衡向逆反应方向移动;
③据原子守恒和电子守恒,可以写为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O,故答案为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O;
④氧气在Ⅱ电极上发生氧化反应,电极Ⅰ上发生还原反应,NO2被氧化生成的氧化物只能是N2O5,电极Ⅰ上的电极反应式为:NO2+NO3--e-═N2O5,生成1molN2O5,失去1mol电子,得到1mol电子需要0.25mol氧气,0.25mol×22.4L/mol=5.6L,故答案为:NO2+NO3--e-═N2O5;5.6.
②反应4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O(g)△H=-1627.2kJ?mol-1是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,
故答案为:温度升高,发生了副反应:4NH3+5O2═4NO+6H2O;温度升高,NOx和NH3反应的化学平衡向逆反应方向移动;
③据原子守恒和电子守恒,可以写为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O,故答案为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O;
④氧气在Ⅱ电极上发生氧化反应,电极Ⅰ上发生还原反应,NO2被氧化生成的氧化物只能是N2O5,电极Ⅰ上的电极反应式为:NO2+NO3--e-═N2O5,生成1molN2O5,失去1mol电子,得到1mol电子需要0.25mol氧气,0.25mol×22.4L/mol=5.6L,故答案为:NO2+NO3--e-═N2O5;5.6.
点评:本题考查了化学平衡的移动、氧化还原反应方程式的书写、电极反应式书写及电子守恒的应用,题目难度中等.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
在盐酸与铁的反应中,盐酸( )
| A、是氧化剂 |
| B、是还原剂 |
| C、不是氧化剂也不是还原剂 |
| D、既是氧化剂又是还原剂 |
已知天然气的主要成分是CH4,下列关于CH4的说法中正确的是( )
①CH4分子具有正四面体结构
②天然气与煤、柴油相比是较洁净的能源
③CH4是结构最简单的烷烃.
①CH4分子具有正四面体结构
②天然气与煤、柴油相比是较洁净的能源
③CH4是结构最简单的烷烃.
| A、只有①正确 |
| B、只有②正确 |
| C、只有③正确 |
| D、全部都正确 |
某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是( )
| A、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(NH4+)+c(H+)>c(Cl-)+c(OH-) |
 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:
