题目内容
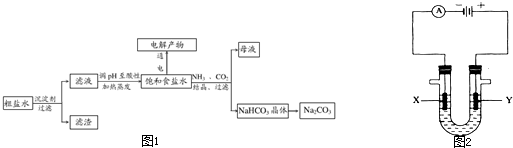
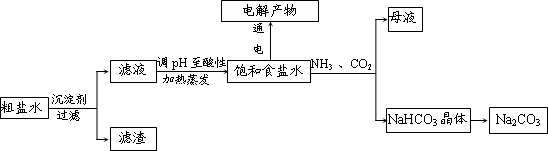
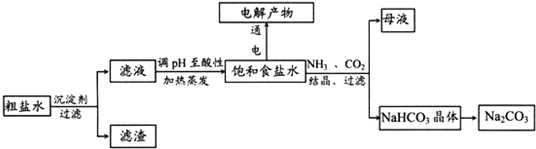
以食盐为原料进行生产并综合利用的某些过程如图所示.

(1)除去粗盐中的Ca2+、Mg2+和S
离子,加入下列沉淀剂的顺序是(填序号)
a.Na2CO3b.NaOHc.BaCl2
(2)将滤液的pH调至酸性除去的离子是
(3)如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是
(5)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是

(1)除去粗盐中的Ca2+、Mg2+和S
| O | 2- 4 |
cab或者cba或者bca
cab或者cba或者bca
.a.Na2CO3b.NaOHc.BaCl2
(2)将滤液的pH调至酸性除去的离子是
CO32-和OH-
CO32-和OH-
.(3)如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是
2H++2e-=H2↑
2H++2e-=H2↑
,在X极附近观察到的现象是有无色气泡产生,溶液变红
有无色气泡产生,溶液变红
;Y电极上的电极反应式是2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,检验该电极反应产物的方法是将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生
将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生
.电解NaCl溶液的离子方程式是2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
.
| ||
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是
NH3
NH3
.(5)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
1×1010
1×1010
.分析:(1)根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀;
(2)加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(3)根据电解氯化钠溶液的原理方程式以及氯气和氢氧化钠之间的反应结合题干来回答;
(4)根据发生的反应和流程图中可循环使用的物质种类回答;
(5)氢氧化钠中氢氧根离子是完全是水电离出的,碳酸钠溶液中氢氧根离子是水完全电离生成的,结合离子积计算判断.
(2)加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(3)根据电解氯化钠溶液的原理方程式以及氯气和氢氧化钠之间的反应结合题干来回答;
(4)根据发生的反应和流程图中可循环使用的物质种类回答;
(5)氢氧化钠中氢氧根离子是完全是水电离出的,碳酸钠溶液中氢氧根离子是水完全电离生成的,结合离子积计算判断.
解答:解:(1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤,故答案为:cab或cba或bca;
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)和电源的负极相连的是电解池的阴极,该电极上的电极反应为:2H++2e-=H2↑,氢离子浓度减小,所以碱性增强,酚酞变红,和电源的正极相连的是阳极,该机反应式为:2Cl--2e-=Cl2↑,氯气可以将碘离子氧化为碘单质,碘单质遇到淀粉变蓝色,根据两极上的电极反应可以得到总反应为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,
故答案为:2H++2e-=H2↑;有无色气泡产生,溶液变红;2Cl--2e-=Cl2↑;将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(4)向分离出NaHCO3晶体后的母液中加入过量生石灰,发生的反应有H2O+CaO=Ca(OH)2、Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物为氯化钙、氨气,其中氨气可再利用,
故答案为:NH3;
(5)pH 为11碳酸钠溶液中[H+]剩余?[OH-]水=10-14;[OH-]水=10-3mol/L,Na2CO3溶液中加入过量石灰乳,反应生成碳酸钙和氢氧化钠,所得溶液pH=13,则此时水电离出的c(OH-)的值是10-13mol/L,所以反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是1×1010,故答案为:1×1010.
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)和电源的负极相连的是电解池的阴极,该电极上的电极反应为:2H++2e-=H2↑,氢离子浓度减小,所以碱性增强,酚酞变红,和电源的正极相连的是阳极,该机反应式为:2Cl--2e-=Cl2↑,氯气可以将碘离子氧化为碘单质,碘单质遇到淀粉变蓝色,根据两极上的电极反应可以得到总反应为:2Cl-+2H2O
| ||
故答案为:2H++2e-=H2↑;有无色气泡产生,溶液变红;2Cl--2e-=Cl2↑;将湿润的KI淀粉试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生;2Cl-+2H2O
| ||
(4)向分离出NaHCO3晶体后的母液中加入过量生石灰,发生的反应有H2O+CaO=Ca(OH)2、Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物为氯化钙、氨气,其中氨气可再利用,
故答案为:NH3;
(5)pH 为11碳酸钠溶液中[H+]剩余?[OH-]水=10-14;[OH-]水=10-3mol/L,Na2CO3溶液中加入过量石灰乳,反应生成碳酸钙和氢氧化钠,所得溶液pH=13,则此时水电离出的c(OH-)的值是10-13mol/L,所以反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是1×1010,故答案为:1×1010.
点评:本题是一道实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强难度较大,对训练学生良好地思维品质以及知识的严密性有较好的帮助.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目

 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的