题目内容
7.1100℃时,在体积为5L的密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:(1)上述反应中涉及的非金属元素原子的半径从大到小的顺序为S>O>H,非金属性最强的元素原子的电子排布式
 ,其电子的自旋方向共有2种.
,其电子的自旋方向共有2种.(2)该反应中O、S属于同主族元素,比较它们的单质的氧化性2H2S+O2=2S↓+2H2O(用化学方程式表示),写出Na2O的电子式
 ,比较Na2O和Na2S的熔点高低:Na2O>Na2S.
,比较Na2O和Na2S的熔点高低:Na2O>Na2S.(3)上述平衡的平衡常数表达式K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$.
降低温度,K值减小,则正反应为吸热(填“吸热”或“放热”)反应.
(4)能判断反应达到平衡状态的依据是BC(填序号).
A.混合气体的压强不变 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.各气体的浓度相等
(5)若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,V(H2)=27.7.2×10-4mol/(L•min),.平衡后,向容器中充入1molH2,平衡向正反应方向(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,H2的体积百分含量不变(填“增大”、“减小”或“不变”)
分析 (1)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大;
非金属性最强的元素为O元素,原子核外电子排布式为1s22s22p4,根据泡利原理与洪特规则画出原子的轨道表示式,电子的自旋方向共有2种;
(2)同主族非金属元素形成的单质为氧气、硫,可以利用单质之间置换反应比较单质的氧化性强弱;根据离子化合物的成键特点来书写电子式即可;
(3)平衡常数是指生成物平衡浓度化学计量数幂乘积与反应物平衡浓度化学计量数幂乘积的比,固体不需要标出;
降低温度,K值减小,说明降低温度平衡向逆反应方向移动;
(4)A.混合气体的压强始终不变;
B.混合气体的总质量随反应进行发生变化,容器容积不变,混合气体的密度不变可以说明到达平衡;
C.混合气体的总物质的量不变,总质量分数变化,故混合气体的平均相对分子质量不变,可以说明到达平衡;
D.平衡时气体的浓度与反应物转化率有关;
(5)若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,即△n(Na2SO4)=$\frac{2.84g×45%}{142g/mol}$=0.009mol,据此求出△n(H2)和反应速率;
通入氢气,氢气的浓度增大,平衡右移.
解答 解:(1)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故非金属元素原子半径:S>O>H;
非金属性最强的元素为O元素,原子核外电子排布式为1s22s22p4,原子的轨道表示式为 ,电子的自旋方向共有2种;
,电子的自旋方向共有2种;
故答案为:S>O>H; ;2;
;2;
(2)同主族非金属元素形成的单质为氧气、硫,利用单质之间置换反应比较单质的氧化性强弱,反应方程式为:2H2S+O2=2S↓+2H2O,Na2O是钠离子和氧离子之间通过离子键形成的离子化合物,所属的晶体类型是离子晶体,电子式为: ,Na2O的熔点高于Na2S的熔点.
,Na2O的熔点高于Na2S的熔点.
故答案为:2H2S+O2=2S↓+2H2O; ;>;
;>;
(3)Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)的平衡常数表达式K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;
降低温度,K值减小,说明降低温度平衡向逆反应方向移动,逆反应为放热反应,则正反应为吸热反应,
故答案为:$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;吸热;
(4)A.反应前后气体的物质的量不变,混合气体的压强始终不变,故A错误;
B.混合气体的总质量随反应进行发生变化,容器容积不变,混合气体的密度不变可以说明到达平衡,故B正确;
C.混合气体的总物质的量不变,总质量分数变化,故混合气体的平均相对分子质量不变,可以说明到达平衡,故C正确;
D.平衡时气体的浓度与反应物转化率有关,平衡时的浓度不一定相等,故D错误,
故选:BC;
(5)若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,即△n(Na2SO4)=$\frac{2.84g×45%}{142g/mol}$=0.009mol,故△n(H2)=0.009mol,反应速率V(H2)=$\frac{\frac{0.009mol}{5L}}{10min}$=27.7.2×10-4mol/(L•min);再通入氢气,平衡右移,氢气的浓度不变. 故答案为:27.7.2×10-4mol/(L•min),正反应方向,不变.
点评 本题是一道化学平衡的综合题,反应达平衡的标志、反应速率的计算和化学平衡常数的计算等是高频考点,应加强练习.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 一定条件下水由气态变为液态 | B. | H2燃烧生成水 | ||
| C. | 将散落的火柴放入火柴盒 | D. | 溶解少量食盐于水中 |
| A. | 铁粉与氯化铁恰好完全反应,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | 氧化产物和还原产物的物质的量之比为1:2 | |
| D. | 反应后溶液中Fe2+ 离子的浓度为 4 mol•L-1 |
| A. | 水银温度计不慎摔破,水银洒在桌面上,立即覆盖一层硫磺粉 | |
| B. | 在无药量说明的情况下,取用稀硫酸10mL | |
| C. | 把盛有液体的蒸发皿直接放在铁架台的铁圈上加热 | |
| D. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯、后点燃 |
| A. | 钢 | B. | 水银 | C. | 金刚石 | D. | 四氧化三铁 |
| A. | 小苏打--Na2CO3 | B. | 熟石灰--Ca (OH)2 | C. | 漂白粉-Ca(ClO)2 | D. | 氯水--Cl2 |
| A. | Al→Al2O3→Al(OH)3→NaAlO2 | B. | Fe→FeO→Fe(OH)2→Fe(OH)3 | ||
| C. | S→SO3→H2SO4→MgSO4 | D. | N2→NO→NO2→HNO3 |
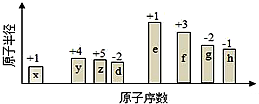 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题: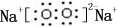 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)