题目内容
6.设NA为阿伏伽德常数的数值,下列说法正确的是( )| A. | 18 g H2O含有10NA个质子 | |
| B. | 1 mol甲苯含有6NA个C-H键 | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A、求出水的物质的量,然后根据水为10质子微粒来分析;
B、甲苯中含8个氢原子;
C、标况下,氨水为液体;
D、铁在浓硫酸中会钝化.
解答 解:A、18g水的物质的量为1mol,而水为10质子微粒,故1mol水中含10mol质子即10NA个,故A正确;
B、甲苯中含8个氢原子,故含8molC-H键即8NA个,故B错误;
C、标况下,氨水为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、铁在浓硫酸中会钝化,不能完全反应,则生成的二氧化硫的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.氢气是人类未来最理想的燃料,以水为原料大量制取氢气的最理想的途径是( )
| A. | 由热电站提供电力电解水产生氢 | |
| B. | 用铁和盐酸反应放出氢气 | |
| C. | 利用太阳能在一定条件下使水分解产生氢气 | |
| D. | 以焦炭和水制取水煤气(含CO和H2)后分离出氢气 |
11.下列说法中不正确的是( )
| A. | 在甲、乙两烧杯的溶液中,共含有Cu2+、K-、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是:K+、OH-、CO32- | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的BaO2固体后,CH3COO-浓度变化最小 | |
| D. | 常温下水电离出的c(OH-)=10-10的溶液中:Na+、ClO-、S2-、NH4+不能大量共存 |
17.下列实验操作:
①浓硫酸的稀释
②称取一定质量的NaOH固体
③配制100ml0.1mol/l的NaCl溶液
④用CCl4萃取碘水的I2
⑤用自来水制取蒸馏水,
一定要用到玻璃棒的是( )
①浓硫酸的稀释
②称取一定质量的NaOH固体
③配制100ml0.1mol/l的NaCl溶液
④用CCl4萃取碘水的I2
⑤用自来水制取蒸馏水,
一定要用到玻璃棒的是( )
| A. | ①②③ | B. | ②③④ | C. | ③⑤ | D. | ①③ |
12.下列表述正确的是( )
| A. | 氢氧根离子的电子式是 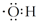 | |
| B. | 二氧化碳分子的比例模型是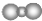 | |
| C. | 芳香烃的组成通式是CnH2n-6(n≥6) | |
| D. | 12C和14C的原子结构示意图均可表示为 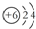 |
11.下列说法错误的是( )
| A. | 微粒半径:S<S2-<K | B. | 稳定性:H2O>H2S>PH3 | ||
| C. | 酸性:H3PO4<HNO3<HClO4 | D. | 沸点:HF<HCl<HBr<HI |
 ;
;