题目内容
19.下列不能水解的糖类是( )| A. | 纤维素 | B. | 果糖 | C. | 麦芽糖 | D. | 淀粉 |
分析 有机物中二糖中的蔗糖和麦芽糖、多糖中的纤维素和淀粉、酯类、蛋白质等在一定条件下能发生水解,单糖不能发生水解,
解答 解:A.纤维素是多糖催化剂作用下水解生成葡萄糖,故A不符合;
B.果糖是单糖不能发生水解,故B符合;
C.麦芽糖是双糖稀硫酸作用下水解生成葡萄糖;,故C不符合
D.淀粉是多糖稀硫酸作用下加热水解最终生成葡萄糖,故D不符合;
故选B.
点评 本题考查了有机物能水解的性质分析判断,主要是糖类中水解的理解应用,注意知识积累,题目难度不大.

练习册系列答案
相关题目
20.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |
7.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成,放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究.
已知:①NiCl4易溶于水,Fe2+不能氧化Ni2+.
②某温度下一些金属氢氧化物的KSP及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-.
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5 mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
已知:①NiCl4易溶于水,Fe2+不能氧化Ni2+.
②某温度下一些金属氢氧化物的KSP及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | KSP | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-52 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-38 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-.
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5 mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
4.化学与生活息息相关,下列说法错误的是( )
| A. | 用SO2漂白过的草帽辫日久会变色 | |
| B. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |
11.下列叙述中,错误的是( )
| A. | 苯与浓硫酸共热并保持70-80℃反应生成苯磺酸 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
8.工业上常利用液晶显示屏生产过程中产生的废玻璃粉末为原料回收金属铈(Ce),金属铈是一种重要的稀土元素,原子序数为58,它有四种同位素,该元素的相对原子质量为140,下列有关说法正确的是( )
| A. | 它是第5周期元素 | |
| B. | 原子核内一定有82个中子 | |
| C. | 铈的四种同位素形成的中性原子,核外电子数相同 | |
| D. | Ce2+中有55个质子 |
 工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.
工业上制硫酸的第二步反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下通入2mol SO2(g)和1mol O2(g)达到平衡时,其反应速率关系如图所示.维持温度、压强不变,在t1时刻充入2mol SO3(g),t2时反应达到新的平衡.请画出t1~t3正、逆反应速率v正、v逆的变化示意图.
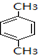
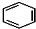 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$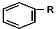 +HCl(-R为烃基)
+HCl(-R为烃基) $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$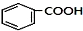
 .
.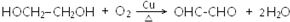 .
.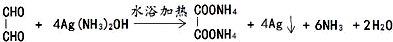 .
.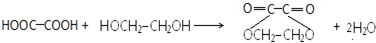 .
.


