题目内容
2.可以准确判断有机物分子中含有哪些官能团的分析方法是( )| A. | 核磁共振氢谱 | B. | 质谱 | C. | 紫外光谱 | D. | 红外光谱 |
分析 利用红外光谱法可确定有机物分子中含有的官能团,以此来解答.
解答 解:A.核磁共振氢谱法可确定分子中不同位置的H的数目,故A不选;
B.质谱法可确定分子的相对分子质量,故B不选;
C.用于紫外吸收化合物的定性鉴别及定量分析,故C不选;
D.红外光谱法可确定有机物分子中含有的官能团,故D选;
故选D.
点评 本题考查有有机物的官能团与性质的关系,题目难度不大,注意有机物结构的测定方法即可解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列解释事实的方程式不正确的是( )
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+=CaCO3 | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:2H2O2 $\frac{\underline{\;CuSO_{4}\;}}{\;}$2H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
1.同温同压下,x g甲气体和y g乙气体占有相同的体积,根据阿伏伽德罗定律判断,x:y的值可以表示( )
| A. | 甲与乙的物质的量之比 | |
| B. | 等质量的甲与乙的分子个数之比 | |
| C. | 同温同压下,甲与乙的密度之比 | |
| D. | 同温同体积下,等质量的甲与乙的压强之比 |
18.下列各装置能组成原电池的是( )
| A. |  乙醇 | B. | 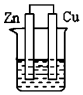 稀H2SO4 | C. |  稀H2SO4 | D. |  稀H2SO4 |
5.下列叙述中,正确的是( )
| A. | 具有规则几何外形的固体一定是晶体 | |
| B. | 晶体与非晶体的根本区别在于是否具有规则的几何外形 | |
| C. | 晶体、非晶体具有固定的熔点 | |
| D. | 具有各向异性的固体一定是晶体 |
7.以2-氯丙烷为主要原料制1,2-丙二醇时,依次经过的反应类型为( )
| A. | 消去反应→加成反应→取代反应 | B. | 加成反应→消去反应→取代反应 | ||
| C. | 消去反应→取代反应→加成反应 | D. | 取代反应→加成反应→消去反应 |
14.某氮肥样品可能含有NH4HCO3、NH4C1、NH4NO3中的一种或几种.称取该样品1.000克,溶于水配成100mL溶液.将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL 0.2mol•L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出).
②向另一份溶液中加入足量的6mol•L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mL 0.15mol•L-1的硫酸才能被完全反应.下列说法正确的是( )
①向一份溶液中加入10mL 0.2mol•L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出).
②向另一份溶液中加入足量的6mol•L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mL 0.15mol•L-1的硫酸才能被完全反应.下列说法正确的是( )
| A. | 1.000 g样品中一定含有NH4HCO3 0.316克 | |
| B. | 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4C1 | |
| C. | 原样品的含氮量为21% | |
| D. | 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl |
11.水溶液中下列表达式正确的是( )
| A. | H2SO3的电离:H2SO3?2H++SO32- | |
| B. | NaHSO3的水解:HSO3-+H2O?H3O++SO32- | |
| C. | NaHS的水解:HS-+H2O?H2S+OH- | |
| D. | BaSO4溶液中存在平衡:BaSO4?Ba2++SO42- |
12.下列实验装置正确且能达到预期实验目的是( )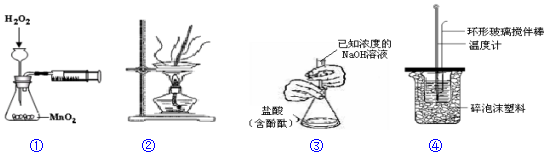

| A. | 装置①用于测定H2O2分解的反应速率 | |
| B. | 装置②用于蒸发FeCl3溶液制取FeC13晶体 | |
| C. | 装置③用于测定未知浓度的盐酸的浓度 | |
| D. | 装置④用于测定中和热 |