题目内容
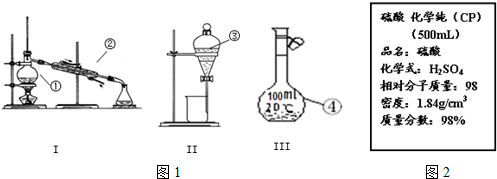
16.关于分液漏斗的使用,下列说法正确的是( )| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| C. | 在分液漏斗中加入萃取剂后应上下颠倒摇匀使萃取剂与溶质充分接触 | |
| D. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 |
分析 分液漏斗用于分离互不相溶的液体,分液时下层液体从下端流出,上层液体从上端到处,且注意检验分液漏斗的玻璃塞和旋塞是否漏水,以此解答该题.
解答 解:A.碘、酒精与四氯化碳混溶,溶液不分层,不能分液分离,故A错误;
B.放出下层液体时,应打开上方的玻璃塞,以使内外压强相等,使液体顺利流出,且使下端管口紧贴烧杯内壁,防止液体飞溅,故B正确;
C.在分液漏斗中加入萃取剂后应用左手握住分液漏斗活塞,右手压住分液漏斗口部,把分液漏斗倒转过来振荡,使两种液体充分接触,振荡后打开活塞,将漏斗内气体放出,故C错误;
D.应检验分液漏斗的玻璃塞和旋塞是否漏水,故D错误.
故选B.
点评 本题考查物质的分离、提纯,侧重于分液的考查,注意把握分液的操作方法以及注意事项,学习中注意相关基础的积累,难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
14.已知有关物质的熔、沸点数据如表:
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.5×105 Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
1.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 250mL2mol•L-1的氨水中含有NH3•H2O的分子数为0.5NA | |
| B. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| C. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | t℃时,pH=6 的纯水中含有OH-的个数为10-6NA |
8.NaHS不属于( )
| A. | 酸式盐 | B. | 含氧酸盐 | C. | 钠盐 | D. | 无氧酸盐 |
5.肼可用作火箭燃料燃烧时发生反应是:N2O4+2N2H4═3N2+4H2O,若该反应中有4molN-H断裂,则形成的π键有( )
| A. | 1mol | B. | 2 mol | C. | 3mol | D. | 4mol |
6.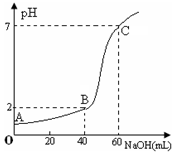 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )| A. | 所用盐酸的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L─1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+) | |
| C. | A、B、C三点水的电离程度大小依次为:C>B>A | |
| D. | 滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低 |