��Ŀ����
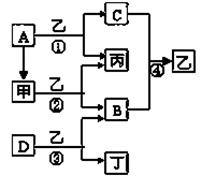
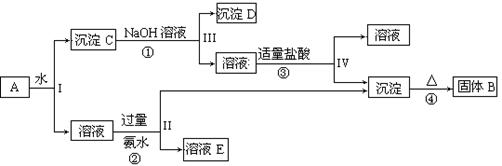
A��B��C��D��EΪ��ѧ��ѧ�����ĵ��ʻ�����ת����ϵ����ͼ��ʾ��
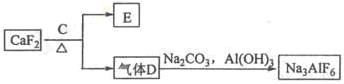
��1����A�ǵ���ɫ�����������D����ɫ���壻C�к��е����������Ӿ�Ϊ10�������ӡ�
��д����ӦA��B�Ļ�ѧ����ʽ ��
�ڽ�һ����������Dͨ��2 L C����Һ�У���������Һ�б���μ���ϡ����������������������������������ʵ����Ĺ�ϵ��ͼ������������ܽ��HCl�Ļӷ�������ش�O����Һ���������ʵĻ�ѧʽΪ ��a����Һ�и�����Ũ���ɴ�С�Ĺ�ϵ�� ��
��2��������1���е�����Dͨ������������Һ�еò�����F��F��KSP=8.1��10-9���ֽ��ó�������0.1mol/L ��BaCl2��Һ�У���KSP ���������С�� �䣩����ɲ�����F������������Һ�е�Ũ��Ϊ mol/L��
��1��2CO2 + 2Na2O2�� 2Na2CO3 + O2 (3��)NaOH��Na2CO3 (2��)
c(Na+)��c(Cl-)��c(HCO3-)��c(OH-)��c(H+)��c(CO32-) (3��)
��2������ (2��) �� 8.1��10-8 (2��)
��������������������Ϲ�ϵͼȷ��AΪ�������ƣ�BΪ̼���ƣ�CΪ�������ƣ�����A��B��ѧ����ʽΪ2CO2 + 2Na2O2�� 2Na2CO3 + O2����̼���������ᷴӦ���ص�Na2CO3+HCl=NaHCO3+NaCl��NaHCO3+HCl=NaCl+H2O+CO2������������ͬ�������ᣬ����ȷ��ͼ��O�������ΪNaOH��Na2CO3 ��a ��Ϊ3molNaCl��2molNaHCO3,����Ũ�ȴ�СΪ c(Na+)��c(Cl-)��c(HCO3-)��c(OH-)��c(H+)��c(CO32-) ��Kspֻ���¶�Ӱ�죬���Բ��䣬��c��SO42-��=Ksp��BaSO4��/c(Ba2+)=8.1��10-8.
���㣺�ƵĻ����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д��Ի�ͭ����Ҫ�ɷ�ΪCuFeS2������������SiO2�ȣ�Ϊԭ�Ͻ�����ͭ��ͬʱ�õ�����Ʒ�̷���FeSO4��7H2O��������Ҫ�������£�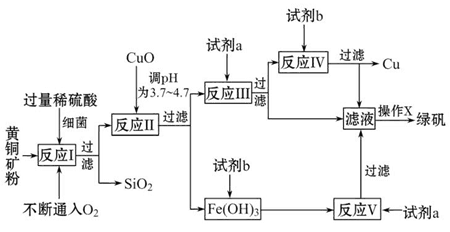
��֪���� 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2��SO4��3+2H2O
�ڲ���������������������ʽ��ʼ��������ȫ����ʱ��Һ��pH���
| ������ | Cu��OH��2 | Fe��OH��3 | Fe��OH��2 |
| ��ʼ����pH | 4��7 | 2��7 | 7��6 |
| ��ȫ����pH | 6��7 | 3��7 | 9��6 |
��1���Լ�a��__________���Լ�b��__________��
��2������XӦΪ����Ũ����__________��__________��
��3����Ӧ���м�CuO��pHΪ__________��Ŀ����ʹFe3+�γ�Fe��OH��3��������ֹ����Cu��OH��2������
��4����Ӧ�������ӷ���ʽΪ��__________________________________________��
 4Al+3O2���������ʯ������:_______________________________��
4Al+3O2���������ʯ������:_______________________________��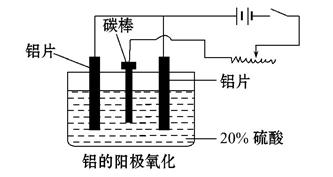
 xH2O)�������²�����
xH2O)�������²�����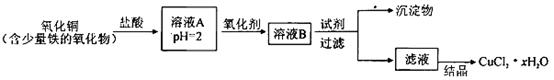

 ��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺
��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺ ��Cu
��Cu ��Fe
��Fe