题目内容
15.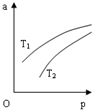 在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )| A. | T1>T2 | |
| B. | 其他条件不变,增大压强,可提高单位时间内 NH3的产量 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当 n(N2):n(H2):n(NH3)=1:3:2 时,反应一定达到平衡状态 |
分析 A、由N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,可知升高温度平衡向逆向移动结合图象分析;
B、增大压强平衡向体积减小的方向移动;
C、由N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,可知升高温度平衡向逆向移动分析;
D、当 n(N2):n(H2):n(NH3)=1:3:2 时,不能说明正逆反应速率一定相等.
解答 解:A、由N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,可知升高温度平衡向逆向移动,则温度越高NH3在平衡混合气体中的体积分数越低,所以由图象可知T1<T2,故A错误;
B、增大压强平衡向体积减小的方向移动,即向正反应移动,则可提高单位时间内 NH3的产量,故B正确;
C、由N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,可知升高温度平衡向逆向移动,所以化学平衡常数减小,故C错误;
D、当 n(N2):n(H2):n(NH3)=1:3:2 时,不能说明正逆反应速率一定相等,所以反应不一定达到平衡状态,故D错误;
故选B.
点评 本题考查化学平衡图象、化学平衡的影响因素以及平衡状态的判断等问题,题目难度不大,注意相关知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列物质中不属于电解质的是( )
| A. | HF | B. | 酒精 | C. | AlCl3 | D. | Cu(OH)2 |
10.下列反应的离子方程式书写正确的是( )
| A. | 碳酸氢钠溶液中滴入氢氧化钠溶液:CO32-+H++OH-=CO32-+H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+H2O | |
| C. | 用NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 向氢氧化钠溶液中通入过量的二氧化碳:CO2+2OH-=CO32-+H2O |
20.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10 mL时,2c(C2O42-)>c(Na+)>c(HC2O4-) |
7.下列关于原子结构的说法正确的是( )
| A. | 原子由原子核和核外电子构成 | |
| B. | 对于任何微粒,质子数等于核外电子数都成立 | |
| C. | 当微粒达到稳定结构时,最外层电子数一定是8 | |
| D. | 原子的质量等于原子核的质量 |
4.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 含NA个阴离子的Na2O2溶于水形成1L溶液,其物质的量的浓度为1mol/L | |
| B. | 25g质量分数为68%的H2O2水溶液中含有氧原子数目为NA | |
| C. | 常温常压下,0.1molD2O含有中子数为NA | |
| D. | 用5mL3mol/LFeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA |