题目内容
10.下列反应的离子方程式书写正确的是( )| A. | 碳酸氢钠溶液中滴入氢氧化钠溶液:CO32-+H++OH-=CO32-+H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+H2O | |
| C. | 用NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 向氢氧化钠溶液中通入过量的二氧化碳:CO2+2OH-=CO32-+H2O |
分析 A.碳酸氢根离子不能拆分;
B.漏写氧化剂水,生成偏铝酸钠和氢气;
C.反应生成偏铝酸钠和水;
D.反应生成碳酸氢钠.
解答 解:A.碳酸氢钠溶液中滴入氢氧化钠溶液的离子反应为HCO3-+OH-=CO32-+H2O,故A错误;
B.浓烧碱溶液中加入铝片的离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;
C.NaOH溶液溶解Al2O3的离子反应为2OH-+Al2O3=2AlO2-+H2O,故C正确;
D.向氢氧化钠溶液中通入过量的二氧化碳的离子反应为CO2+OH-=HCO3-,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
20.下列叙述错误的是( )
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6 |
1.化学中有许多物质之间的反应符合如图转化.图中其他产物及反应所需条件均已略去.下列说法不正确的是( )
A$\stackrel{X}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{O_{2}}{→}$D.
A$\stackrel{X}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{O_{2}}{→}$D.
| A. | 当A是正盐,X是强酸时,D是酸性氧化物 | |
| B. | 当X时强碱溶液时,B一定时NH3 | |
| C. | B可能是单质 | |
| D. | D可能是一种酸 |
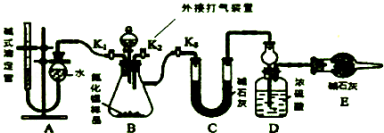
18.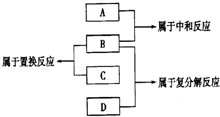 现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
 现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )
现有A B C D四种物质,他们分别为铁、盐酸、氢氧化钠溶液、硝酸银溶液四种物质中一种,它们之间反应关系及所发生的反应类型如图,下列物质对应正确的是( )| A. | A铁 | B. | B盐酸 | C. | C氢氧化钠溶液 | D. | D硝酸银溶液 |
5.将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的虚线所示.其中正确的是( )
| A. | 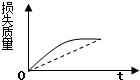 | B. | 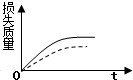 | C. | 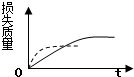 | D. | 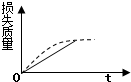 |
15.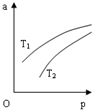 在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
 在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )
在密闭容器中发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ•mol-1,NH3 在 平衡混合气体中的体积分数(a)与温度(T)、压强(p)的关系如图所示.下列判 断正确的是( )| A. | T1>T2 | |
| B. | 其他条件不变,增大压强,可提高单位时间内 NH3的产量 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当 n(N2):n(H2):n(NH3)=1:3:2 时,反应一定达到平衡状态 |
19.下列判断错误的是( )
| A. | 沸点:H2S>H2Se | B. | 熔点:NaCl>CCl4 | ||
| C. | 酸性:HClO4>H2SO4 | D. | 碱性:NaOH>Mg(OH)2 |