题目内容
一定能在下列溶液中大量共存的离子是( )
| A、水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、I- |
| B、能使pH试纸变深蓝色的溶液:Na+、K+、AlO2-、CO32- |
| C、含有大量Fe3+的溶液:K+、Fe2+、HCO3-、Br- |
| D、澄清透明的无色溶液:ClO-、SO32-、K+、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.水电离产生的c(H+)=1×10-12mol/L溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
B.能使pH试纸变深蓝色的溶液呈碱性;
C.与Fe3+反应的离子不能大量共存;
D.发生氧化还原反应的离子不能大量共存.
B.能使pH试纸变深蓝色的溶液呈碱性;
C.与Fe3+反应的离子不能大量共存;
D.发生氧化还原反应的离子不能大量共存.
解答:
解:A.水电离产生的c(H+)=1×10-12mol/L溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,碱性条件下NH4+不能大量共存,故A错误;
B.能使pH试纸变深蓝色的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故B正确;
C.HCO3-与Fe3+发生互促水解反应,不能大量共存,故C错误;
D.ClO-、SO32-发生氧化还原反应而不能大量共存,故D错误.
故选B.
B.能使pH试纸变深蓝色的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故B正确;
C.HCO3-与Fe3+发生互促水解反应,不能大量共存,故C错误;
D.ClO-、SO32-发生氧化还原反应而不能大量共存,故D错误.
故选B.
点评:本题考查离子共存问题,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握常见离子的性质以及反应类型的判断,答题时注意把握题给信息,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
下列叙述正确的是( )
| A、血红蛋白、牛胰岛素、蚕丝、过氧化氢酶、人造奶油充分水解均可得到氨基酸 |
| B、金刚石、石墨、碳纳米管、C60均有很高的熔、沸点 |
| C、天然气、沼气、酒精、水煤气均属于可再生能源 |
| D、用脱硫处理的煤代替原煤作燃料不能有效减少空气中CO2含量 |
在盐酸滴定NaOH溶液的实验中,以酚酞试液作指示剂,滴定到终点时颜色变化是( )
| A、由无色变红色 |
| B、由红色变无色 |
| C、由红色变蓝色 |
| D、由蓝色变红色 |
下列实验操作正确的是( )
| A、保存液溴时,上层用水液封并装在带橡胶塞的试剂瓶中 |
| B、在蒸发皿中加热Na2CO3?10H2O使其脱水 |
| C、用酸式滴定管量取6.55mL的KMnO4溶液 |
| D、用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物 |
下列物质中,常温下能反应产生气体的是( )
| A、浓硫酸和铜 |
| B、稀硫酸和铜 |
| C、浓硝酸和铁 |
| D、稀硫酸和铝 |
对下列实验过程的评价,正确的是( )
| A、往某溶液中先加稀硝酸,再加入AgNO3溶液,有白色沉淀,证明溶液中一定含Cl- |
| B、某溶液中先滴加BaCl2溶液,再加盐酸,生成白色沉淀,证明溶液中一定含有SO42- |
| C、某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
| D、某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
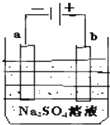 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )| A、逸出气体的体积,a电极的小于b电极的 |
| B、有一电极逸出有刺激性气味的气体 |
| C、a电极附近呈红色,b电极附近呈蓝色 |
| D、a电极附近呈蓝色,b电极附近呈红色 |
下列食物中属于酸性食物的是( )
| A、豆腐 | B、柠檬酸 | C、鸡蛋 | D、黄瓜 |