题目内容
【题目】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O![]() 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________。
(2)尿素水解液呈碱性,则c(![]() )___________ c(
)___________ c(![]() )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成![]() 的离子方程式为___________。
的离子方程式为___________。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
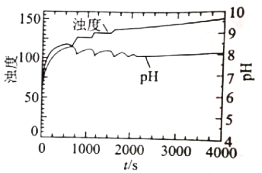
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
【答案】沉淀颗粒过大 > ![]()
![]()
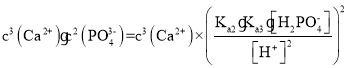 =
= ,不能生成沉淀 A
,不能生成沉淀 A
【解析】
(1)试验目的是制备纳米磷酸钙,若搅拌速率降低,可能形成的固体颗粒较大,
故答案为:沉淀颗粒过大;
(2)由电荷守恒可知:![]() ,溶液呈碱性,故c(OH-)>c(H+),故c(
,溶液呈碱性,故c(OH-)>c(H+),故c(![]() )> c(
)> c(![]() ),
),
故答案为:>;
(3)①Na3PO4溶液与盐酸反应生成NaH2PO4,其离子方程式为:![]() ,
,
故答案为:![]() ;
;
②![]() 的水解常数Kh=
的水解常数Kh=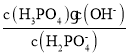 =
=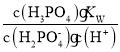 =
=![]() =1.3×10-12<Ka2,
=1.3×10-12<Ka2,![]() 电离出的
电离出的![]() 较低,故
较低,故![]() 浓度最小,故含磷微粒浓度从大到小的顺序为:
浓度最小,故含磷微粒浓度从大到小的顺序为:![]() ,
,
故答案为:![]() ;
;
③Qsp=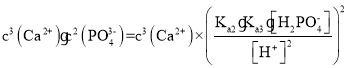 =
= ,不能生成沉淀,
,不能生成沉淀,
故答案为:Qsp=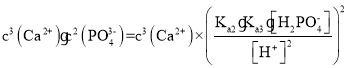 =
= ,不能生成沉淀;
,不能生成沉淀;
(4)A、振荡周期内,溶液的pH会发生变化,![]() 浓度受到溶液酸碱度的影响也会发生相应的变化,故A符合题意;
浓度受到溶液酸碱度的影响也会发生相应的变化,故A符合题意;
C、随着磷酸钙沉淀的生成,磷酸根浓度逐渐减小,其水解量逐渐减小,溶液的碱性逐渐降低,pH会下降,故C不符合题意;
D、尿素水解导致溶液呈碱性,磷酸水解导致溶液呈碱性,但二者的速率可能存在差异,因此会导致pH周期性振荡,故D不符合题意;
故答案为:A。

 名校课堂系列答案
名校课堂系列答案