题目内容
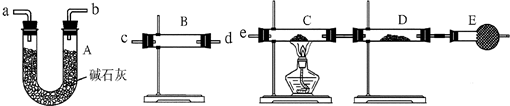
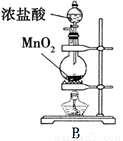
装置Ⅰ和装置Ⅱ、装置Ⅲ是有关硝酸和铜反应的实验装置示意图:

(1)若用装置Ⅰ进行铜与浓硝酸反应的实验,最大的缺点是________;若用装置Ⅰ来证明铜与稀硝酸反应生成NO气体,其最大缺点是不能与浓硝酸跟铜反应形成鲜明对照效果.简述原因________.
(2)若用装置Ⅱ进行适当操作,即可克服上述缺点,还能使上述两反应在同一试管中先后连续进行.实验步骤如下:
步骤一:组装好装置并________后,加入2 mL浓硝酸(铜片接近酸液),塞紧胶塞.
步骤二:________(操作)使反应发生.当导管口有少量红棕色气体逸出时,________(操作使反应停止).同时将导管插入水中.稍后能观察到:a.水沿导管倒吸至试管中;还可能观察到下列________(填序号)等明显现象:b.溶液由蓝色变为无色;c.铜片表面产生气泡;d.红棕色气体变为无色.请解释产生现象a的原因________.
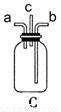
步骤三:当试管中溶液体积约占试管容积![]() 时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ).这样做的目的是________和________.
时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ).这样做的目的是________和________.
步骤四:反应完毕后,……
(3)上述实验“步骤四”中反应完毕后还需要进行的操作是________.
解析:
|
(1)生成的NO2(或氮的氧化物)扩散到大气中,污染环境 生成的NO与空气相接触,被氧化成红棕色的NO2气体 (2)检验气密性 将铜片插入溶液中(或向左侧倾斜试管,使铜片浸在浓HNO3中) 抽动铜片使其和溶液脱离接触 cd NO2气体易溶于水,气体体积减小,使导管内压强减小,大气压将水压入试管中观察铜片与稀硝酸反应的现象 防止氮的氧化物逸出,污染空气 (3)处理残气、残液、洗净铜丝及仪器、整理仪器(实验台) |
提示:
|
本题巧妙地将Cu或HNO3反应设计成实验内容,考查实验操作能力、分析能力、设计能力. |

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案