题目内容
8.在容积不变的密闭容器中,在一定条件下发生反应:2A?B(g)+C(g),且达到平衡.当升高温度时气体的密度增大,则( )| A. | 若正反应是吸热反应,则A为非气态 | B. | 若正反应是吸热反应,则A为气态 | ||
| C. | 若正反应是放热反应,则A为气态 | D. | 若正反应是放热反应,则A为非气态 |
分析 达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,要使气体的密度增大,根据ρ=$\frac{m}{M}$知,A一定为非气态,平衡正向移动,正反应是吸热反应,由此分析解答.
解答 解:对于可逆反应2A?B(g)+C(g),达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,要使气体的密度增大,根据ρ=$\frac{m}{M}$知,A一定为非气态,平衡正向移动,所以正反应是吸热反应,故选A.
点评 本题考查化学平衡的影响因素,题目难度中等,解答本题的关键是容器密度的变化,答题时注意体会.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
18.制造焊锡时,把铅加入锡的主要原因是( )
| A. | 增加强度 | B. | 增加抗腐蚀能力 | C. | 增加延展性 | D. | 降低熔点 |
19.下列气体中,有颜色的是( )
| A. | O2 | B. | Cl2 | C. | SO2 | D. | NH3 |
16.常温下,物质的量浓度相同的三种盐NaX、NaY和NaZ溶液的pH值依次为8、9、10,则下列表达式错误的是( )
| A. | Z-+H2O═HZ+OH- | B. | HY+H2O═H3O++Y- | ||
| C. | 常温下,电离度:HX>HY>HZ | D. | HX+Z-→X-+HZ |
3.在下列各溶液中,离子一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 含Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | pH=13的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 强碱性溶液中:K+、Al3+、Cl-、SO42- |
13.下列说法正确的是( )
| A. | 不用其它试剂便无法区别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液 | |
| B. | 实验室常用带玻璃塞的试剂瓶保存NaOH溶液 | |
| C. | 用导线将电解池和电池连接,电子从电池的负极流向电解池的阳极 | |
| D. | 用以下反应制取硫酸铜:2Cu+O2═2CuO、CuO+H2SO4=CuSO4+H2O符合绿色化学的理念 |
20.用NA表示阿佛加德罗常数,下列叙述正确的是( )
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
7.将物质的量浓度为Xmol/L的稀盐酸与物质的量浓度为Xmol/L的稀NaOH溶液等体积混合,所得溶液的pH=2(混合后体积不变),则X和Y的关系是( )
| A. | X=Y+0.01 | B. | X=2Y | C. | Y=2X | D. | X=Y+0.02 |
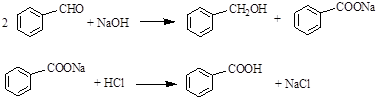
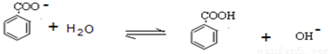 .
.