题目内容
8.C、N、S都是重要的非佥属元素,下列说法正确的是( )| A. | 三者对应的氧化物均为酸性氧化物 | |
| B. | 三者的单质直接与氧气反应都能生成两种及以上氧化物 | |
| C. | 三者对应氢化物的水溶液可能呈中性、碱性、酸性 | |
| D. | C02、N02、S02都能与H20反应,其反应类型相同 |
分析 A.CO、NO为不成盐氧化物;
B.氮气和氧气反应生成NO,硫在氧气中燃烧生成二氧化硫;
C.三者对应氢化物的水溶液分别是甲烷、氨水、氢硫酸;
D.二氧化氮和水反应属于氧化还原反应.
解答 解:A.三者对应的氧化物中CO、NO为不成盐氧化物,所以三者对应的氧化物不均为酸性氧化物,故A错误;
B.氮气和氧气反应生成NO,NO被氧气氧化生成二氧化氮,S在氧气中燃烧生成二氧化硫,单质N、S直接与氧气反应都能生成一种氧化物,故B错误;
C.三者对应氢化物的水溶液分别是甲烷、氨水、氢硫酸,分别呈中性、碱性、酸性,故C正确;
D.CO2+H2O=H2CO3、SO2+H2O=H2SO3中没有电子转移属于非氧化还原反应,3NO2+H2O=2HNO3+NO中有电子转移属于氧化还原反应,故D错误;
故选C.
点评 本题考查非金属元素及其化合物的性质,涉及尾气处理、氧化还原反应的判断等知识点,熟练掌握C、N、S、Cl元素及其化合物性质并灵活运用,题目难度不大.

练习册系列答案
相关题目
18.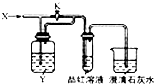 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.下列实验操作都能够达到预期目的是( )
①用pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
①用pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
| A. | ②④⑥ | B. | ②⑥ | C. | ⑤ | D. | ④⑤⑥ |
16.下列有关物质分类和氧化还原的描述正确的是( )
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 元素的单质可由氧化或还原含该元素的化合物来制得 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 |
3.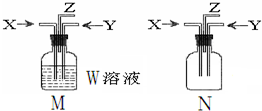 利用如图M、N两个装置进行相关实验,下列有关说法正确的是( )
利用如图M、N两个装置进行相关实验,下列有关说法正确的是( )
 利用如图M、N两个装置进行相关实验,下列有关说法正确的是( )
利用如图M、N两个装置进行相关实验,下列有关说法正确的是( )| 选项 | 所用装置 | 描述 | 结论 |
| A | M | W:BaCl2;X:CO2 Y:SO2 | M中有白色沉淀生成 |
| B | M | W:饱和食盐水;先通入X:CO2,再通入Y:NH3 | M中制得小苏打 |
| C | N | X:NH3 Y:Cl2 | Z出口有白烟产生 |
| D | N | X:NH3Y:O2 | Z出口有红棕色气体 |
| A. | A | B. | B | C. | C | D. | D |
13.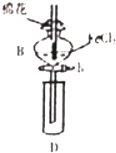 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
20.常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7 | |
| B. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |
17.下列属于吸热反应同时又属于氧化还原反应的是( )
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |
18.下列反应的离子方程式正确的是( )
| A. | 将过量的氯气通入碘化亚铁溶液:3Cl2+2Fe2++4I-═6Cl-+2Fe3++2I2 | |
| B. | 硫酸在加热条件下将铜氧化:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 在氢氧化钡溶液中加入过量的硫酸氢铵:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3↑+2H2O | |
| D. | 将金属钠投入水中:2Na+2H+═2Na++H2↑ |