题目内容
13.下列离子反应方程式书写正确的是( )| A. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气溶于水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH${\;}_{4}^{+}$+OH-═NH3↑+H2O |
分析 A.金属钠与水反应生成NaOH和氢气,电子、电荷守恒;
B.碳酸钙为沉淀,在离子反应中保留化学式;
C.次氯酸为弱酸,在离子反应中保留化学式;
D.NH4HCO3与过量的浓KOH溶液混合生成一水合氨、碳酸钠和水.
解答 解:A.金属钠和水发生置换反应,反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.盐酸与碳酸钙反应,碳酸钙是难溶物,不能拆成离子形式,离子反应为:CaCO3+2H+=CO2↑+H2O+Ca2+,故B错误;
C.次氯酸为弱酸,不能完全电离,不能拆成离子形式,离子反应为:Cl2+H2O═H++Cl-+HClO,故C错误;
D.NH4HCO3与过量KOH溶液混合生成一水合氨、碳酸钠和水,离子方程式为NH4++HCO3-+2OH-═NH3•H2O+CO32-+H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
4.电解含重水(D2O)的普通水,当电路中有4mol电子通过时,测得两惰性电极上共产生36.5g气体,则在生成的气体中${\;}_{1}^{2}$H和${\;}_{1}^{1}$H的质量比为( )
| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 2:7 |
1.下列有关物质应用的说法中,不正确的是( )
| A. | Na2C03是发酵粉的主要成分之一 | B. | Mg0常用作耐高温材料 | ||
| C. | SiO2可用于制造光导纤维 | D. | 工业上可用Cl2制造漂白粉 |
5.下列过程应用于工业生产的是( )
| A. | 锌与稀硫酸反应制取氢气 | B. | 氯化铵和氢氧化钙制取氨气 | ||
| C. | 浓盐酸和二氧化锰反应制取氯气 | D. | 氯气与石灰乳反应制取漂白粉 |
2. 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图.
放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.
已知:N2(g)+3H2(g)═2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据计算a 的数值391
(4)已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=+226.7kJ•mol-1.
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图.
放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=+226.7kJ•mol-1.

 ;
;
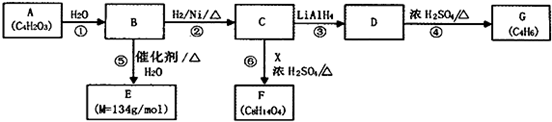
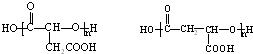 .
.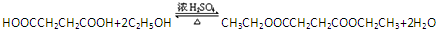 .
. .
.