题目内容
下列离子方程式中,正确的是( )
| A、钠和水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、醋酸与NaOH溶液反应:H++OH-=H2O |
| C、氯气通入氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
| D、向AlCl3溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.根据电荷守恒判断,离子方程式两边电荷不相等;
B.醋酸为弱电解质,离子方程式中应该保留分子式;
C.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,根据电荷守恒和质量守恒定律判断;
D.氨水碱性较弱,铝离子与氨水反应生成氢氧化铝沉淀.
B.醋酸为弱电解质,离子方程式中应该保留分子式;
C.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,根据电荷守恒和质量守恒定律判断;
D.氨水碱性较弱,铝离子与氨水反应生成氢氧化铝沉淀.
解答:
解:A.钠和水反应生成氢氧化钠和氢气,题中离子方程式电荷不守恒,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.醋酸与NaOH溶液反应,醋酸需要保留分子式,正确的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,故B错误;
C.氯气通入氢氧化钠溶液中,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D.氯化铝加入过量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
B.醋酸与NaOH溶液反应,醋酸需要保留分子式,正确的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,故B错误;
C.氯气通入氢氧化钠溶液中,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D.氯化铝加入过量氨水生成氢氧化铝沉淀和氯化铵,氢氧化铝难溶于弱碱氨水,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,侧重对学生能力的培养和训练,该题需要明确判断离子方程式常用方法(1)检查反应能否发生;(2)检查反应物、生成物是否正确;(3)检查各物质拆分是否正确;(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、氢氧化钡溶液与硫酸反应:H++OH-=H2O |
| B、铁溶于氯化铁溶液:Fe3++Fe=2Fe2+ |
| C、氢氧化钠溶液与硫酸铜溶液反应:2OH-+Cu2+=Cu(OH)2↓ |
| D、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
根据下列变化,判断属于还原反应的是( )
| A、HCl→Cl2 |
| B、S→SO2 |
| C、Fe(OH)3→Fe2O3 |
| D、CuO→Cu |
Se是人体必需的微量元素,其中
Se的原子棱内中子数是( )
80 34 |
| A、80 | B、46 | C、34 | D、12 |
短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数相差8,A原子的最外层电子数是其次外层电子数的3倍,B单质的焰色反应为黄色.下列说法正确的是( )
| A、气态氢化物的热稳定性:A<C |
| B、元素A与B只能形成一种化合物 |
| C、最高价氧化物对应的水化物的酸性:C>D |
| D、原子半径的大小顺序:rB>rC>rD>rA |
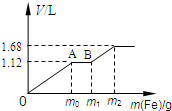 向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )| A、产生氢气的体积为1.68L |
| B、产生二氧化氮的体积为1.12L |
| C、参加反应铁粉的总质量m2=5.6g |
| D、原混合溶液中c(HNO3)=0.5 mol?L-1 |