题目内容
9.下列对实际应用原理解释的表达式中,不正确的是( )| A. | 用排饱和食盐水法收集Cl2 Cl2+H2O?H++Cl-+HClO | |
| B. | 纯碱溶液加热使溶液碱性增强CO32-+2H2O?H2CO3+2OH- | |
| C. | 向Mg(OH)2悬浊液中加入FeCl3溶液,悬浊液颜色改变3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+ | |
| D. | 配制FeCl3溶液时,为防止溶液浑浊,常将FeCl3固体溶解于浓盐酸,再加水稀释Fe3++3H2O?Fe(OH)3+3H+ |
分析 A.氯气与水反应生成氯化氢和次氯酸,次氯酸为弱酸保留化学式;
B.碳酸根离子分步水解,以第一步为主,水解生成碳酸氢根离子和氢氧根离子;
C.氢氧化铁溶解度小于氢氧化铜,依据沉淀转化规律;
D.三价铁离子水解生成氢氧化铁和氢离子,依据沉淀溶解平衡可知加入氢离子抑制三价铁离子水解;
解答 解:A.用排饱和食盐水法收集Cl2 ,离子方程式:Cl2+H2O?H++Cl-+HClO,故A正确;
B.纯碱溶液加热使溶液碱性增强,离子方程;CO32-+H2O?HCO3-+2OH-,故B错误;
C.向Mg(OH)2悬浊液中加入FeCl3溶液,悬浊液颜色改变,离子方程式:3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+,故C正确;
D.配制FeCl3溶液时,为防止溶液浑浊,常将FeCl3固体溶解于浓盐酸,再加水稀释Fe3++3H2O?Fe(OH)3+3H+,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意盐类水解规律,题目难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
19.分子式为C4H10O的醇与苯甲酸(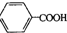 )在一定条件下反应生成酯的种类有( )
)在一定条件下反应生成酯的种类有( )
 )在一定条件下反应生成酯的种类有( )
)在一定条件下反应生成酯的种类有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 2,3-二羟基丙醛是最简单的醛糖 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为 ,该有机物的结构简式为 ,该有机物的结构简式为 |
17.下列各组互为同位素的是( )
| A. | 氧气、臭氧 | B. | 重氢、超重氢 | C. | 纯碱、苏打 | D. | 乙酸、甲酸 |
4.有机反应①酯化反应 ②取代反应 ③消去反应 ④加成反应 ⑤水解反应 ⑥还原反应.能在有机物的分子中引入羟基官能团的反应类型的组合正确是( )
| A. | ①②④⑥ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ②③④ |
14.环丙叉环丙烷(A)由于其特殊的电子结构,一直受到结构和理论化学家的注意,由于缺乏有效的合成途径,一度延缓对其反应的研究,直到1993年出现了可以大量制备的方法.根据下列转化,判断下列说法正确的是( )


| A. | A的所有原子都在一个平面内 | B. | 反应①是加成反应 | ||
| C. | 反应②是消去反应 | D. | A的二取代产物只有1种 |
1.下列反应属于吸热反应的是( )
| A. | 石灰石在高温下的分解反应 | B. | 铝热法炼铁 | ||
| C. | 实验室制氢气 | D. | 木炭在氧气中燃烧 |
18.除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | NaOH溶液 | 洗气 |
| B | C6H6(苯酚) | 浓Br2水 | 过滤 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
19.Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
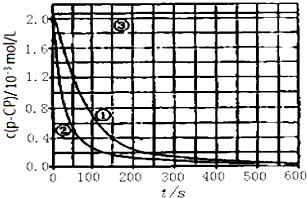
(2)请根据如图实验①曲线,计算降解反应在50-150s内的反应速率:v(p-CP)=8.0×10-6mol/(L•s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解.
(4)实验③得出的结论是:pH等于10时,反应速率趋向于零(或该降解反应趋于停止).
(5)根据题意:在一定条件下H2O2和Fe2+的离子反应式H2O2+2H++2Fe2+=2H2O+2Fe3+.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验.
(1)请完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |

(2)请根据如图实验①曲线,计算降解反应在50-150s内的反应速率:v(p-CP)=8.0×10-6mol/(L•s).
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解.
(4)实验③得出的结论是:pH等于10时,反应速率趋向于零(或该降解反应趋于停止).
(5)根据题意:在一定条件下H2O2和Fe2+的离子反应式H2O2+2H++2Fe2+=2H2O+2Fe3+.