题目内容

(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是___________;应该测定的实验数据是_____________。

(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;测定一定时间产生气体的体积(或者测定一定体积的气体所需时间)

Ⅰ.(4分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(3)如果反应前后的温度差是(t2-t1),盐酸、氢氧化钠溶液的密度均为1g/cm3,比热容为4.18J/(g•℃),写出该实验中和热的计算式:△H=
Ⅱ.(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol/L的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②___________________ |
(1)甲同学表中实验步骤②为____________________________________________。
(2)甲同学的实验目的是______________________________________;要得出正确的实验结论,还需控制的实验条件是________。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是___________。
该实验中不选用某浓度的硫酸,理由是____________。
(13分)
Ⅰ.(3分)下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.(10分)影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积2mol/L的硫酸于试管中 ② |
反应速率Mg>Fe,Cu反应最慢 |
金属性质越活泼,反应 速率越快 |
(1)甲同学表中实验步骤②为 ;
(2) 甲同学的实验目的是 ;要得出正确的实验结论,还需要控制的实验条件是 。
乙同学为了更精确地研究浓度对反应速率的影响,利用右图所示装置进行定量实验。
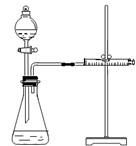
(3)乙同学在实验中应该测定的数据是 ;
(4)乙同学完成实验应选用的实验药品是 。
(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Al和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、
18.4 mol·L-1)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol·L-1的硫酸于试管中 |
反应速率Al>Fe,Cu不反应[来源:学,科,网Z,X,X,K] |
金属的性质越活泼,反应速率越快 |
|
②__________ |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是
要得出正确的实验结论,还需控制的实验条件是
(3)乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。乙同学在实验中应该测定的数据是

(4)乙同学完成该实验应选用的实验药品是
该实验中不选用某浓度的硫酸,理由是
Ⅰ.(4分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品 是 。
(2)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(3)如果反应前后的温度差是(t2-t1),盐酸、氢氧化钠溶液的密度均为1g/cm3,比热容为 4.18J/(g•℃),写出该实验中和热的计算式:△H=
Ⅱ.(12分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积的2 mol/L的硫酸于试管中 |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
|
②___________________ |
(1)甲同学表中实验步骤②为____________________________________________。
(2)甲同学的实验目的是______________________________________;要得出正确的实验结论,还需控制的实验条件是________。
乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是___________。
该实验中不选用某浓度的硫酸,理由是____________。
(8分)他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是____________________ __;
要得出正确的实验结论,还需控制的实验条件是___ _____。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。完成该实验应选用的实验药品是 ;
应该测定的实验数据是____________________________。
