题目内容
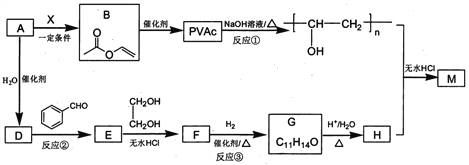
【题目】一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:

(1)反应达到平衡时,平衡常数表达式K=__,升高温度,K值__(填“增大”“减小”或“不变”),该反应是___反应(填“吸热”或“放热”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)__。(用含相应字母的式子表示)
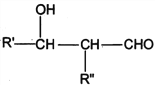
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() ,下列有关该体系的说法正确的是__(填选项字母)。
,下列有关该体系的说法正确的是__(填选项字母)。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H 2 )/n(CH 3 OH)增大
【答案】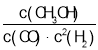 减小 放热
减小 放热 ![]() mol·L-1·min-1 BC
mol·L-1·min-1 BC
【解析】
(1)反应达到平衡时,平衡常数表达式K=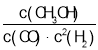 ,从图中可以找出,升高温度与K值变化的关系,从而确定平衡移动的方向及该反应的热效应。
,从图中可以找出,升高温度与K值变化的关系,从而确定平衡移动的方向及该反应的热效应。
(2)在500℃,从反应开始到平衡,由CH3OH的物质的量,可求出参加反应的H2的物质的量,从而求出氢气的平均反应速率v(H2)。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() 。
。
A.氢气的浓度增大,A错误;
B.正反应速率加快,逆反应速率也加快,B正确;
C.平衡正向移动,甲醇的物质的量增加,C正确;
D.重新达平衡时,H2的物质的量减小,CH3OH的物质的量增大,所以n(H2 )/n(CH3OH)减小,D错误。
(1)反应达到平衡时,平衡常数表达式K=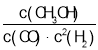 ,从图中可以找出,升高温度,K值减小,则平衡逆向移动,正反应为放热反应。答案为:
,从图中可以找出,升高温度,K值减小,则平衡逆向移动,正反应为放热反应。答案为: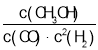 ;减小;放热;
;减小;放热;
(2)在500℃,从反应开始到平衡,n(CH3OH)=nB mol,则参加反应的H2的物质的量为2 nB mol,从而求出氢气的平均反应速率v(H2)=![]() =
= ![]() mol·L-1·min-1。答案为:
mol·L-1·min-1。答案为:![]() mol·L-1·min-1;
mol·L-1·min-1;
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() 。
。
A.氢气的浓度增大,A错误;
B.正反应速率加快,逆反应速率也加快,B正确;
C.平衡正向移动,甲醇的物质的量增加,C正确;
D.重新达平衡时,H2的物质的量减小,CH3OH的物质的量增大,所以n(H2 )/n(CH3OH)减小,D错误。
则有关该体系的说法正确的是BC。答案为:BC。

 优学名师名题系列答案
优学名师名题系列答案【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液。
(1)若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为__mL。滴定终点时的现象是:当滴入最后一滴盐酸时,锥形瓶中溶液颜色由___,且30s不恢复原色。

(2)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据算出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=__mol·L-1。
(3)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是__(填字母)。
A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时俯视读数 D.锥形瓶取用NaOH待测液前加少量水洗涤
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结 论 |
A | 向一定浓度的Na2SiO3 溶液中通入适量CO2 气体, 出现白色沉淀。 | H2SiO3 的酸性比H2CO3的酸性强 |
B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
C | 室温下,测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3- 结合H+ 的能力比SO32-的强 |
D | 分别向25mL冷水和25mL沸水中滴入6滴FeCl3 饱和溶液,前者为黄色,后者为红褐色。 | 温度升高,Fe3+的水解程度增大 |
A.AB.BC.CD.D