题目内容
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) △H<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.升高温度,n(CO)减少B.减小压强,n(CO2)增加
C.更换高效催化剂,CO的转化率增大D.充入一定量的氮气,n(H2)不变
【答案】D
【解析】
A.升高温度,化学平衡向吸热的逆反应方向移动,n(CO)增加,A错误;
B.该反应是反应前后气体体积不变的反应,减小压强,平衡不移动,n(CO2)不变,B错误;
C.催化剂不能使化学平衡发生移动,因此CO的转化率不变,C错误;
D.充入一定量的氮气,由于反应体系的任何物质的浓度不变,所以化学平衡不移动,n(H2)不变,D正确;
故合理选项是D。

【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
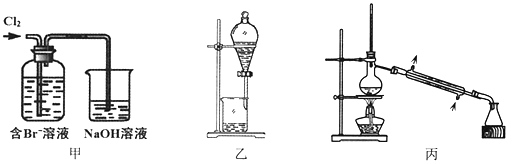
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2


