题目内容
4.硅在无机非金属材料中,扮演着主要角色,请利用相关知识回答下列问题:(1)硅有非常重要的用途,请写出其中的一种制半导体、制电路板、制太阳能电池板、制硅钢等.
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是D.
A.可用氧化物形式表示为BaO•CuO•2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
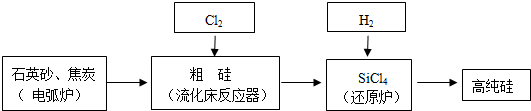
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,再利用化学反应进行的方向的知识判断该反应的△H>0(填<、>或=).
②SiCl4极易水解,其完全水解的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl.
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为蒸馏(精馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)硅位于金属和非金属分界线附近,常用作半导体材料,为无机非金属材料的主角;
(2)A.根据硅酸盐中氧化物的书写顺序来书写;
B.硅酸盐性质稳定;
C.硅酸铜钡的化学式为BaCuSi2OX,利用钡、铜、硅、氧元素的化合价及化合物中正负化合价的代数和为0来解答;
D.硅酸盐能和强酸反应;
(3)①石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅;根据反应不能自发进行△H-T△S>0判断;
②SiCl4水解生成硅酸和氯化氢;
③根据题中数据,采用精馏(或蒸馏)方法提纯SiCl4;
④根据KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子结合得失电子守恒配平;先根据关系式5Fe2+~MnO4-计算出100mL溶液中含有的铁,最后求出质量百分数.
解答 解:(1)硅位于金属和非金属分界线附近,常用作半导体材料,为无机非金属材料的主角,计算机芯片的主要成分为单质硅,太阳能电池的主要成分是硅单质,所以硅可制半导体、制电路板、制太阳能电池板、制硅钢等,
故答案为:制半导体、制电路板、制太阳能电池板、制硅钢等;
(2)A.硅酸盐用氧化物形式表示时,书写顺序为:活泼金属氧化物、不活泼金属氧化物、二氧化硅、水,所以硅酸铜钡用氧化物形式表示:BaO•CuO•2SiO2,故A正确;
B.BaCuSi2O6中铜显+2价,二价铜离子不容易被还原,所以性质较稳定,不容易褪色,故B正确;
C.在硅酸铜钡中的铜元素化合价为+2,硅元素化合价为+4,氧元素的化合价为-2价,钡元素的化合价为+2价,则由化学式为BaCuSi2OX,根据化合物中正负化合价的代数和为0可得:(+2)+(+2)+(+4)×2+(-2)×x=0,解得x=6,故C正确;
D.BaCuSi2O6是弱酸盐,所以能和强酸反应,和强碱不反应,故D错误;
故答案为:D;
(3)①石英砂的主要成分是二氧化硅,制备粗硅发生置换反应,SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,该反应为△S为正值的反应△S>0,该反应不能自发进行,△H-T△S>0,所以△H>0,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si;>;
②SiCl4水解生成硅酸和氯化氢,反应的方程式为:SiCl4+3H2O=H2SiO3↓+4HCl,故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
③利用沸点的不同提纯SiCl4属于蒸馏,SiCl4(沸点57.6℃)中含有少量SiHCl3(沸点33.0℃)和FeCl3(离子化合物沸点很高),SiH2Cl2(沸点8.2℃)、SiH3Cl(沸点-30.4℃)、由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质,
故答案为:精馏(或蒸馏);
④KMnO4溶液具有强氧化性,把二价铁氧化成三价铁,本身被还原成二价锰离子,再根据得失电子守恒配平,则离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,利用关系式法计算:
5Fe2+~MnO4-
5 1
n(Fe2+) 1.000×10-3mol•L-1×0.02L×5
解得:n(Fe2+)=5×10-4mol
铁元素的质量为:5×10-4mol×56g/mol=2.8×10-3g,铁元素的质量分数$\frac{2.8×1{0}^{-3}g}{1g}$×100%=2.8%,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;2.8%.
点评 本题考查了实验方案设计的有关知识,综合了氯气的制法、硅的提纯、滴定法等实验知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,明确硅酸盐用氧化物形式表示时书写顺序,氧化还原的计算,题目难度中等.

| A. | ①③⑤ | B. | ②④ | C. | ③⑤ | D. | ②③⑤ |
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
①
 ②
② ③
③ ④
④ ⑤CH3CH=CHCH3.
⑤CH3CH=CHCH3.| A. | ②③ | B. | ①④ | C. | ①②④ | D. | ①⑤ |
| A. |  | B. |  | C. |  | D. |  |
 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.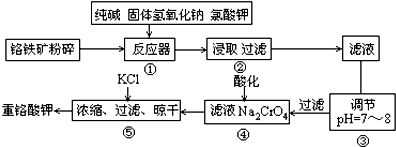
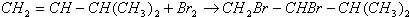 ;
;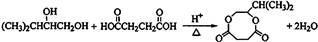 .
.