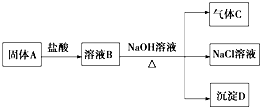
题目内容
19.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的运算;
(2)①CH3OCH3的体积分数随投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的增大而增大,当体积比是3的时候,甲醚的体积分数最大,由极限法可知,投料比无限增大,虽然二氧化碳的转化率增大,但混合气体总体积无限大,而二甲醚的体积无限接近二氧化碳的一半,二甲醚的体积分数减小;
②由图3可知,温度一定时,平衡时二甲醚的物质的量分数:P1>P2>P3>P4,而该反应正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,二甲醚的物质的量分数增大;
由图1可知,投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]一定时,温度越高,平衡时二氧化碳的转化率越高,说明升高温度,平衡向逆反应方向移动,而压强一定时,平衡时二甲醚的物质的量分数:T1<T2<T3<T4;
(3)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动;
设CO的浓度变化量为xmol/L,用三段式表示出平衡时各组分物质的,再根据平衡常数列方程计算解答.
解答 解:(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,③-①×2+②得:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1,
故答案为:CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1;
(2)①CH3OCH3的体积分数随投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的增大而增大,当体积比是3的时候,甲醚的体积分数最大,由极限法可知,投料比无限增大,虽然二氧化碳的转化率增大,但混合气体总体积无限大,而二甲醚的体积无限接近二氧化碳的一半,二甲醚的体积分数减小,故二甲醚的体积分数与投料比的关系为: ,故答案为:
,故答案为: ;
;
②由图3可知,温度一定时,平衡时二甲醚的物质的量分数:P1>P2>P3>P4,而该反应正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,二甲醚的物质的量分数增大,故压强:P1>P2>P3>P4;
由图1可知,投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$]一定时,温度越高,平衡时二氧化碳的转化率越高,说明升高温度,平衡向逆反应方向移动,二甲醚的物质的量分数减小,而压强一定时,平衡时二甲醚的物质的量分数:T1<T2<T3<T4,故温度:T1>T2>T3>T4,
故选:BD;
(3)反应:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数表达式K=$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;
由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡向,逆反应方向移动,则正反应为放热反应;
设CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):0.02 0.02 0 0
转化(mol/L):x x x x
平衡(mol/L):0.02-x 0.02-x x x
则$\frac{x×x}{(0.02-x)×(0.02-x)}$=9,解得x=0.015,
故CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;放热;75%.
点评 本题考查热化学方程式书写、化学平衡图象及影响因素、化学平衡计算等,(2)中作图为易错点,注意利用极限法判断二甲醚的体积分数变化情况,注意平衡常数在化学计算中的应用.

| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| C. | 定容时观察液面俯视 | |
| D. | 定容加水超过刻度线又吸出少量 |
(1)硅有非常重要的用途,请写出其中的一种制半导体、制电路板、制太阳能电池板、制硅钢等.
(2)古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是D.
A.可用氧化物形式表示为BaO•CuO•2SiO2
B.性质稳定,不易脱色
C.x等于6
D.易溶解于强酸和强碱
(3)工业上提纯硅有多种路线,其中一种工艺流程示意图如下:
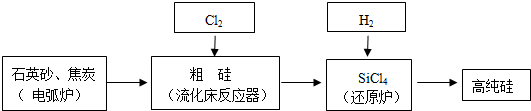
①在电弧炉中发生的反应需要在高温条件进行,写出该反应化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,再利用化学反应进行的方向的知识判断该反应的△H>0(填<、>或=).
②SiCl4极易水解,其完全水解的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl.
③在流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等,有关物质的沸点数据如下表,分离SiCl4和其他杂质的方法为蒸馏(精馏).
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图1所示.(固定装置已略去)
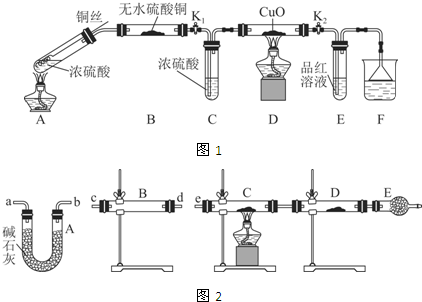
(1)A中反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+SO42-+Cu2++2H2O.
(2)F烧杯中的溶液通常是NaOH溶液(或酸性KMnO4溶液等).
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E中溶液褪色.
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝.
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是氢气和水蒸气;
(2)某同学用下列装置(如图2)连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是cd(或dc)ab(或ba)e(用a、b…填写).
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
 化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.
化学镀铜废液中含有一定量的CuS04,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过.已知:①Cu2++HCHO+30H-=Cu+HCOO-+2H20;
②还原性:HCHO>M(一种金属)>Cu.
下列说法正确的是( )
| A. | 反应之前,应将含OH-的HCHO溶液加人到装置的左侧 | |
| B. | 右侧发生的电极反应式:HCH0-2e-+H20=HC0O-+3H+ | |
| C. | 若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 | |
| D. | 放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
| A. | 二氯丙烷有三种同分异构体 | |
| B. | 碳酸氢钠可用作食品加工中的无铝发泡剂,快速发酵粉 | |
| C. | 二氧化碳制全降解塑料有助于控制温室效应和白色污染 | |
| D. | 某化合物的分子式为C8H10O,其中能与乙酸发生酯化反应的同分异构体有4种 |