题目内容
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 4.6g的乙醇中含有的共价键的数目为0.6NA | |
| B. | 标准状况下,22.4L CHCl3含有的原子数是5NA | |
| C. | 氢氧化燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
分析 A.一个乙醇分子中含有共价键数目是8个共价键;
B.气体摩尔体积适用对象为气体;
C.燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol;
D.5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子.
解答 解:A.4.6g的乙醇的物质的量为$\frac{4.6g}{46g/mol}$=0.1mol,含有共价键0.8mol,数目为0.8NA,故A错误;
B.标况下,三氯甲烷为液体,不能使用气体摩尔体积,故B错误;
C.燃料电池中正极发生还原反应,氢氧燃料电池中正极氧气得到电子,1mol氧气完全反应得到4mol,通过的电子数目为4NA,故C错误;
D.5NH4NO3═2HNO3+4N2↑+9H2O中,铵根离子中N元素化合价由-3价升高为氮气中的0价,共失去15个电子,被还原的氮元素由硝酸根中+5价降低为氮气中的0价,共获得15个电子,则生成1mol氮气转移电子的物质的量=$\frac{15}{4}$=3.75mol,个数为3.75NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握公式的使用和物质的结构是解题的关键,注意标况下的气体摩尔体积使用条件和适用对象,注意氧化还原反应电子得失数目的计算,题目难度不大.

练习册系列答案
相关题目
18.一定温度下,在一个固定容积的密闭容器里发生N2(g)+3H2(g)?2NH3(g)反应,此反应达到化学平衡状态的标志是:①N2,H2和NH3的浓度不再改变,②v正(NH3)=2v逆(N2),③c(N2):c(H2):c(NH3)=1:3:2,④单位时间里每增加1molN2,同时增加3molH2( )
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | 只有①② |
5.下列反应的能量变化属于吸热反应的是( )
| A. | 氢氧化钠溶液与盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 钠与冷水反应 |
2.日本福岛核电站的核原料铀-235(92235U)裂变释放出碘-131(53131I)和铯-137(55137Cs),关于它们的说法正确的是( )
| A. | 铀-235和碘-131是同位素 | B. | 碘-131的质子数为131 | ||
| C. | 铀-235的中子数是143 | D. | 碘-131和铯-137是同种元素 |
6.以苯为原料,不能通过一步反应制得的有机物是( )
| A. | 氯苯 | B. | 硝基苯 | C. | 环己烷 | D. | 苯酚 |

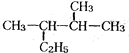
 的一氯取代物有5种
的一氯取代物有5种 发生加聚反应所得产物的结构简式为
发生加聚反应所得产物的结构简式为 .
.
 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式: .
. A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.