题目内容
10.运用元素周期律分析下面推断,不正确的是( )①H-的半径比Li+的半径大
②锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
③砹(At)为有色固体,HAt不稳定
④硒化氢(H2Se)是无色、有毒、比H2S稳定的气体.
⑤硫酸锶(SrSO4)是难溶于水的白色固体.
| A. | ①②③ | B. | ①⑤ | C. | ③④⑤ | D. | ②④ |
分析 ①电子层结构相同,核电荷数越大离子半径越小;
②Li在氧气中燃烧生成Li2O;
③砹为ⅤⅡA族元素,从上到下,单质的颜色加深,状态由气态、液态到固态,非金属性减弱,氢化物稳定性减弱;
④非金属性越强,氢化物越稳定;
⑤Sr与Mg、Ca、Ba同主族,化合物性质相似.
解答 解:①电子层结构相同,核电荷数越大离子半径越小,故H-的半径比Li+的半径大,故正确;
②Li不如Na活泼,在氧气中燃烧生成Li2O,故错误;
③砹为ⅤⅡA族元素,从上到下,单质的颜色加深,状态由气态、液态到固态,则砹(At)为有色固体,从上到下非金属性减弱,则HAt不稳定,故正确;
④S、Se同主族,非金属性S>Se,则H2Se不如H2S稳定,故错误;
⑤Sr与Mg、Ca、Ba同主族,化合物性质相似,则SrSO4是难溶于水的白色固体,故正确,
故选D.
点评 本题考查元素周期表和元素周期律的综合应用,注意理解同主族元素化合物性质的相似性与递变性,题目难度不大.

练习册系列答案
相关题目
20.有关碱金属单质的叙述正确的是( )
| A. | 都可以保存在煤油中 | B. | 随电子层数增加,熔沸点逐渐降低 | ||
| C. | 都是银白色金属,质软,有延展性 | D. | 随电子层数增加,密度逐渐增大 |
1.用水稀释0.1mol L-1的醋酸溶液,其中随水的增加而增大的有( )
①H+的物质的量,②c(H+),③c(OH-),④$\frac{c({H}^{+})}{c(HAc)}$,⑤$\frac{c(HAc)}{c(A{c}^{-})}$.
①H+的物质的量,②c(H+),③c(OH-),④$\frac{c({H}^{+})}{c(HAc)}$,⑤$\frac{c(HAc)}{c(A{c}^{-})}$.
| A. | ①③④ | B. | ①③⑤ | C. | ②④ | D. | ③④ |
18.醋酸钡[(CH3COO)2Ba•H2O]是一种媒染剂,下列是有关0.1mol/L醋酸钡溶液中粒子浓度的比较,其中错误的是( )
| A. | c(H+)=c(OH-)-c(CH3COOH) | B. | c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) | D. | 2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
15.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中不正确的是( )
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X>Y>Z | D. | 原子序数:X>Y>Z |
2.基态铬原子的电子排布式是( )
| A. | 1S22S22p63S23p64S14p5 | B. | 1S22S22p63S23d54S1 | ||
| C. | 1S22S22p63S23p63d6 | D. | 1S22S22p63S23p64S23d4 |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3•H2O分子数为0.1 NA | |
| B. | 0.1 mol•L-1 Na2CO3溶液中所含的Na+离子数为0.2 NA | |
| C. | 标准状况下,2.24 L的水含有的分子数为0.1NA | |
| D. | 一定条件下,3.2 g O2和O3混合气体中含有的O原子数目为0.2 NA |
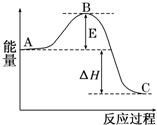 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1molSO3(g)的△H=-99kJ/mol. ;
;