题目内容
20.X、Y、Z、W、M五种短周期元素,X、Y同周期,X、Z同主族,Y形成化合物种类最多,X2-、W3+具有相同的电子层结构,M为短周期主族元素中原子半径最大的元素.下列说法正确的是( )| A. | 原子半径大小顺序为W>X>Z>Y | |
| B. | W元素形成的可溶性盐溶液一定显酸性 | |
| C. | M、X只能形成离子化合物,且形成的离子化合物中只含离子键 | |
| D. | W的最高价氧化物与Z、M的最高价氧化物的水化物均能反应 |
分析 X、Y、Z、W、M五种短周期元素,Y形成化合物种类最多,则Y为C元素;M为短周期主族元素中原子半径最大的元素,则M为Na;X2-、W3+具有相同的电子层结构,X、Y同周期,则X为O元素、W为Al;X、Z同主族,则Z为S元素,据此解答.
解答 解:X、Y、Z、W、M五种短周期元素,Y形成化合物种类最多,则Y为C元素;M为短周期主族元素中原子半径最大的元素,则M为Na;X2-、W3+具有相同的电子层结构,X、Y同周期,则X为O元素、W为Al;X、Z同主族,则Z为S元素.
A.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径:W(Al)>Z(S)>Y(C)>X(O),故A错误;
B.铝盐溶液呈酸性,但偏铝酸盐溶液呈碱性,故B错误;
C.钠与氧形成氧化钠、过氧化钠,均属于离子化合物,但过氧化钠中含有共价键,故C错误;
D.氧化铝属于两性氧化物,既能与硫酸又能与氢氧化钠反应,故D正确,
故选:D.
点评 本题考查位置结构性质的关系和应用,推断元素是解题关键,B选项为易错点,学生容易忽略偏铝酸盐,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
10.常温下,1mol化学键形成(或断裂)的能量变化用E表示.根据表中信息判断,下列说法正确的是( )
| 共价键 | H-H | Cl-Cl | H-Cl |
| E (kJ •mol-1) | 436 | 243 | 432 |
| A. | H2(g)+Cl2(g)=2HCl (g)△H=+247 kJ•mol-1 | |
| B. | H (g)+Cl (g)→HCl (g)△△H=+432 kJ•mol-1 | |
| C. | 1 mol H2(g) 与1 mol Cl2(g) 的总能量高于2 mol HCl (g) 的总能量 | |
| D. | 用电子式表示HCl的形成过程 |
11.下列变化中必须加入还原剂才能实现的是( )
| A. | MnO4-→Mn2+ | B. | HCl→Cl2 | C. | Fe→Fe2+ | D. | KClO3→O2 |
15.下列说法正确的是( )
| A. | 氢氧化铁胶体属于纯净物 | B. | Na2O2是碱性氧化物 | ||
| C. | BaSO4是强电解质 | D. | 纯碱属于碱类物质 |
5.下列说法不正确的是( )
| A. | 利用丁达尔效应可区分溶液和胶体 | |
| B. | 能使湿润的监色石蕊试纸变红的气体是NH3 | |
| C. | 观察钾元素的焰色反应时要透过监色钴玻璃 | |
| D. | 检验溶液中SO42-存在时,先加盐酸酸化,再加氯化钡溶液 |
12.1.92g Cu投入到一定量的浓硝酸中,铜完全溶解,生成的气体的颜色越来越浅,共收集到 672mL 的气体(标准状况下).将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为( )
| A. | 0.336L | B. | 0.224L | C. | 0.168L | D. | 0.504L |
9.下列实际应用不涉及氧化还原反应的是( )
| A. | 工业上粗硅的制备和提纯 | B. | 工业上从海水中提取溴或镁 | ||
| C. | 工业上采用“侯氏制碱法”制纯碱 | D. | 工业上利用合成氨实现氮的固定 |
11.下列物质属于纯净物的是( )
| A. | 碘酒 | B. | 漂白粉 | C. | 氯水 | D. | 液氯 |
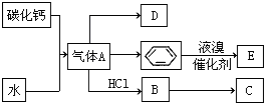 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr;其反应类型为取代反应.
+HBr;其反应类型为取代反应.