题目内容
16.氮元素可以形成多种化合物.回答以下问题:(1)基态氮原子的价电子排布式是2s22p3.
(2)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是三角锥型;N2H4分子中氮原子轨道的杂化类型是sp3.
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ•mol-1,若该反应中有4mol N-H键断裂,则形成的π键有3mol.
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在d(填标号)
a.离子键 b.共价键
c.配位键 d.范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.

下列分子或离子中,能被该有机化合物识别的是c(填标号).
a.CF4 b.CH4
c.NH$\stackrel{+}{4}$ d.H2O.
分析 (1)氮元素是7号元素;
(2)同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
(3)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
②根据氮氢键和生成气体、π键之间的关系式计算;
③根据硫酸铵晶体中存在的化学键判断;
(4)能被该有机物识别即能嵌入空腔形成4个氢键,则要求某分子或离子是正四面体结构且能形成氢键,据此解题.
解答 解:(1)氮原子核外有7个电子,价电子排布式是2s22p3,故答案为:2s22p3;
(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,故答案为:三角锥型;sp3;
②若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成氮气1.5mol,形成的π键有1.5mol×2=3mol,故答案为:3;
③硫酸铵是离子化合物,硫酸铵中存在离子键和共价键,N2H6SO4晶体类型与硫酸铵相同,所以N2H6SO4的晶体内存在离子键、配位键和共价键,不含范德华力,故答案为:d;
(4)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F、O、N等构成的分子间形成的特殊的分子间作用力.符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c.
故选c.
点评 本题考查较综合,涉及核外电子排布、空间构型的判断、晶体中存在的化学键等知识点,分子空间构型是考试热点,要注重基础知识的积累.

| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
| A. | 消耗1molA的同时消耗1mol B | B. | 消耗n molA,同时生成2nmolC | ||
| C. | 气体的总体积不变 | D. | 容器内气体密度不变 |
| A. | 回收电池中的石墨电极 | |
| B. | 回收电池外壳金属材料 | |
| C. | 防止电池中汞、镉、铜等重金属对土壤和水源的污染 | |
| D. | 防止电池中的渗出液腐蚀其它物品 |
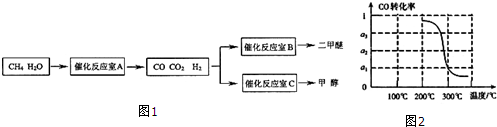


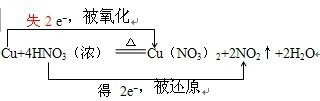 .
.