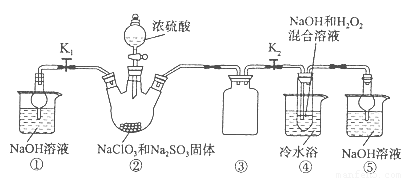
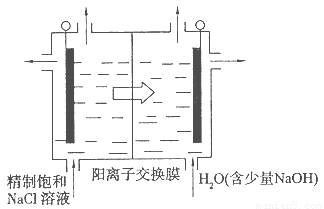
题目内容
取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定,在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_____。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸、润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
D

练习册系列答案
相关题目