题目内容
(1)HCl与足量NaHCO3反应,生成5.85g氯化钠,问需要HCl多少mol?生成的CO2在标准状况下的体积是多少mL?
(2)1g H2、16g O2和22g CO2的物质的量各为多少?在标准状况下,它们的体积是否相等?
(2)1g H2、16g O2和22g CO2的物质的量各为多少?在标准状况下,它们的体积是否相等?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据氯原子守恒计算氯化氢的物质的量,根据二氧化碳和氯化钠之间的关系式计算二氧化碳的体积;
(2)根据n=
、V=nVm进行计算.
(2)根据n=
| m |
| M |
解答:
解:(1)n(NaCl)=
=0.1mol,根据氯原子守恒得n(HCl)=n(NaCl)=0.1mol;
该反应方程式为HCl+NaHCO3=NaCl+H2O+CO2↑,根据氯化钠和二氧化碳的关系式知,n(NaCl)=n(CO2),所以生成二氧化碳的体积=0.1mol×22.4L/mol=2.24L,
答:需要HCl的物质的量为0.1mol、二氧化碳的体积是2.24L;
(2)氢气的摩尔质量是2g/mol、氧气的摩尔质量是32g/mol、二氧化碳的摩尔质量是44g/mol,
氢气的物质的量=
=0.5mol,
氧气的物质的量=
=0.5mol,
二氧化碳的物质的量=
=0.5mol,
标况下,气体摩尔体积相等,根据V=nVm知,相同条件下,其体积之比等于其物质的量之比,三种气体的物质的量相等,所以体积相等,
答:1g H2、16g O2和22g CO2的物质的量各为0.5mol;在标准状况下,它们的体积相等.
| 5.85g |
| 58.5g/mol |
该反应方程式为HCl+NaHCO3=NaCl+H2O+CO2↑,根据氯化钠和二氧化碳的关系式知,n(NaCl)=n(CO2),所以生成二氧化碳的体积=0.1mol×22.4L/mol=2.24L,
答:需要HCl的物质的量为0.1mol、二氧化碳的体积是2.24L;
(2)氢气的摩尔质量是2g/mol、氧气的摩尔质量是32g/mol、二氧化碳的摩尔质量是44g/mol,
氢气的物质的量=
| 1g |
| 2g/mol |
氧气的物质的量=
| 16g |
| 32g/mol |
二氧化碳的物质的量=
| 22g |
| 44g/mol |
标况下,气体摩尔体积相等,根据V=nVm知,相同条件下,其体积之比等于其物质的量之比,三种气体的物质的量相等,所以体积相等,
答:1g H2、16g O2和22g CO2的物质的量各为0.5mol;在标准状况下,它们的体积相等.
点评:本题考查了物质的量的有关计算,根据原子守恒、物质之间的关系结合基本公式来分析解答,灵活运用公式是解本题关键,题目难度不大.

练习册系列答案
相关题目
向FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀,最终得到的固体物质是( )
| A、Fe2O3 |
| B、FeO |
| C、Fe(OH)3 |
| D、Fe2O3 和Fe3O4 |
当两极都用银片作电极电解硝酸银水溶液时,在阳极的产物是( )
| A、只有银 | B、只有氢气 |
| C、银和氢气 | D、上述都不对 |
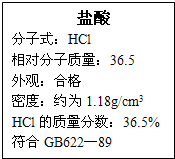 右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答:
右图为某市售盐酸试剂瓶标签上的部分数据,通过计算回答: