题目内容
8.甲烷的燃烧热△H=-890.3kJ•mol-1,1kg CH4在25℃,101kPa时充分燃烧生成液态水放出的热量约为( )| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
分析 燃烧热是在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,甲烷的燃烧热890.3kJ•mol-1,即1molCH4在25℃,101kPa时充分燃烧生成液态水放出的热量为890.3kJ,先求出1kg甲烷的物质的量,然后计算出1kg甲烷完全燃烧放出的热量.
解答 解:1kg甲烷的物质的量为:n=$\frac{1000g}{16g/mol}$=62.5mol,甲烷的燃烧热△H=-890.3kJ•mol-1,说明1molCH4在25℃,101kPa时充分燃烧生成液态水放出的热量为890.3kJ,则62.5mol甲烷在25℃,101kPa时充分燃烧生成液态水放出的热量为:890.3kJ•mol-1×62.5mol=5.56×104kJ,
故选C
点评 本题考查了燃烧热的定义及反应热的有关计算,题目难度不大,明确燃烧热的概念为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
18.一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s)+CO2?2CO(g),不能判断反应已经达到化学平衡状态的是( )
| A. | v(CO2)=v(CO) | B. | 容器中总压强不变 | ||
| C. | 容器中混合气体的密度不变 | D. | 各组分浓度不再随时间而变化 |
19.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
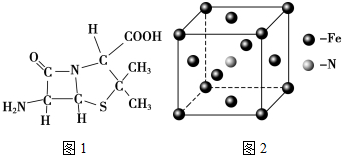
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯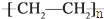 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2.若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$g•cm-3.

(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯
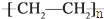 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
16.下列说法不正确的是( )
| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
13.下列实验操作正确的是( )(填序号).
| A. | 用带橡皮塞的棕色试剂瓶存放浓硝酸 | |
| B. | 容量瓶、分液漏斗使用前均需检查是否漏水 | |
| C. | 分液漏斗分液时,必须先将下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸馏时,需将温度计的水银球没入液面以下且不接触烧瓶壁 | |
| E. | 氨气喷泉实验时,收集气体的烧瓶必须干燥 | |
| F. | 用玻璃棒蘸取待测液,点在润湿的pH试纸上测定其pH |
20.下列说法中错误的是( )
| A. | 常温下硫的氧化物都是气体,通入水中都形成强酸 | |
| B. | 将FeCl3滴入饱和H2S溶液中,溶液的pH降低 | |
| C. | 将CO2通入CaSO4溶液中,无明显现象 | |
| D. | 充分利用含硫矿物,既可实现资源的有效利用,还可减轻酸雨污染 |
17.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| B. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| C. | 200 mL 5 mol•L-1 Na2CO3溶液中,含6.02×1023个CO32- | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
