题目内容
在盛有1000mL 0.2mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中.用锌、铜作电极,用导线连接形成原电池,当电路中有1mol电子通过时,试完成:
(1)写出正极的电极反应:正极: .
(2)电极上消耗锌的质量为 g,电极上析出铜的质量为 g.
(3)产生的氢气在标准状况下的体积为 L.
(1)写出正极的电极反应:正极:
(2)电极上消耗锌的质量为
(3)产生的氢气在标准状况下的体积为
考点:电解原理
专题:电化学专题
分析:用锌、铜作电极,CuSO4和H2SO4混合溶液为电解质,构成的原电池中,金属锌是负极,铜是正极,正极上发生反应:Cu2++2e-=Cu,2H++2e-=H2↑,负极上发生反应Zn-2e-=Zn2+,根据电极反应结合电子守恒来计算即可.
解答:
解:(1)用锌、铜作电极,CuSO4和H2SO4混合溶液为电解质,构成的原电池中,金属锌是负极,铜是正极,正极上发生反应:Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
(2)1000mL 0.2mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中,含有铜离子是0.2mol,氢离子是0.8mol,电池负极上发生反应Zn-2e-=Zn2+,当电路中有1mol电子通过时,消耗的金属锌是0.5mol,质量是0.5mol×65g/mol=32.5g,正极上发生反应:Cu2++2e-=Cu,铜离子是0.2mol,转移电子是0.4mol,析出金属铜是0.5mol,质量是0.2mol×64g/mol=32g,故答案为:32.5;32;
(3)正极上发生反应:Cu2++2e-=Cu,铜离子是0.2mol,转移电子是0.4mol,该极上还会发生反应:2H++2e-=H2↑,转移剩余的0.6mol电子,生成氢气0.3mol,体积是0.3mol×22.4L/mol=6.72L,故答案为:6.72.
故答案为:Cu2++2e-=Cu;
(2)1000mL 0.2mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中,含有铜离子是0.2mol,氢离子是0.8mol,电池负极上发生反应Zn-2e-=Zn2+,当电路中有1mol电子通过时,消耗的金属锌是0.5mol,质量是0.5mol×65g/mol=32.5g,正极上发生反应:Cu2++2e-=Cu,铜离子是0.2mol,转移电子是0.4mol,析出金属铜是0.5mol,质量是0.2mol×64g/mol=32g,故答案为:32.5;32;
(3)正极上发生反应:Cu2++2e-=Cu,铜离子是0.2mol,转移电子是0.4mol,该极上还会发生反应:2H++2e-=H2↑,转移剩余的0.6mol电子,生成氢气0.3mol,体积是0.3mol×22.4L/mol=6.72L,故答案为:6.72.
点评:本题涉及电解池的工作原理的应用,注意电极反应式的书写以及离子的放电顺序、电子守恒的应用是关键,难度不大.

练习册系列答案
相关题目
要检验己烯中是否混有少量甲苯,正确的实验方法是( )
| A、先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| B、点燃这种液体,然后再观察火焰的颜色 |
| C、先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| D、加入浓硫酸与浓硝酸后加热 |
化学与生活、社会密切相关.下列说法不正确的是( )
| A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
某溶液中含有两种溶质NaCl和H2SO4,物质的量之比为3:1.用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( )
| A、阴极只析出H2 |
| B、阳极先析出Cl2,后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
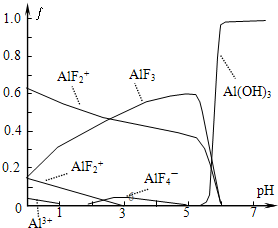 氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.