题目内容
2.硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.在纺织工业中用于棉织品漂白后的脱氯剂、染毛织物的硫染剂、靛蓝染料的防白剂、纸浆脱氯剂、医药工业中用作洗涤剂、消毒剂和褪色剂等,它易溶于水,难溶于乙醇,加热易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图: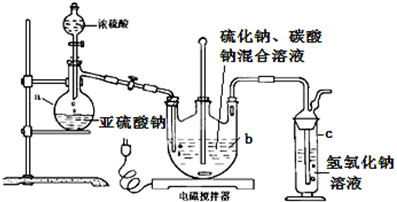
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动.
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2气体.
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜.
④冷却结晶、抽滤、洗涤.
⑤将晶体放入烘箱中,在40~45℃左右干燥50~60min,称量.
请回答以下问题:
(1)仪器b的名称是三颈烧瓶;
(2)步骤②中若控制PH值小于7,则产率会下降,请用离子方程式解释原因:S2O32-+2H+=S↓+H2O+SO2↑.
(3)步骤③中不能将溶液蒸发至干的原因是蒸干会使硫代硫酸钠脱水并分解;晶膜通常在溶液表面出现的原因是因为溶液表面温度较低.
(4)步骤④中洗涤硫代硫酸钠晶体试剂的结构式是
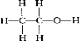 .
.(5)下列有关抽滤的说法中,正确的是A B D.
A.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量洗涤液于试管中进行相关实验
B.抽滤前先用溶剂将滤纸湿润,使滤纸与漏斗底部贴紧
C.抽滤结束时应先关抽气泵,后抽掉抽滤瓶接管
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(6)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点.实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时俯视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
E.滴定时震荡锥形瓶较剧烈.
分析 (1)由仪器结构特征,可知b为三颈烧瓶;
(2)Na2S2O3在酸性条件下会反应生成S和二氧化硫;
(3)由题给信息:硫代硫酸钠“加热易分解”回答即可;溶液表面的温度较低,据此解答即可;
(4)硫代硫酸钠易溶于水,难溶于乙醇,据此选择的洗涤试剂为乙醇;
(5)在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失;由于装置中存在压强差,所以为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验,据此解答即可;
(6)根据方程式找出关系式:IO3-~6S2O32-,根据碘酸根离子的物质的量求出硫代硫酸钠的物质的量浓度,求出250mL溶液中硫代硫酸钠晶体的质量,与总质量5g相比得纯度;
A.滴定管末用Na2S2O3溶液润洗,则Na2S2O3溶液会被稀释;
B.滴定终点时俯视读数,使Na2S2O3溶液体积偏小;
C.锥形瓶用蒸馏水润洗,对实验结果没影响;
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡,使读出的Na2S2O3的体积变小;
E.剧烈震荡锥形瓶,会导致待测液溅出,测定消耗标准液的体积减小,测定结果偏低;根据反应2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后碘单质的物质的量计算出Na2S2O3•5H2O质量及产品的纯度.
解答 解:(1)仪器b为三颈烧瓶,故答案为:三颈烧瓶;
(2)Na2S2O3在酸性条件下会生成S和二氧化硫,产率会下降,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑;故答案为:S2O32-+2H+=S↓+H2O+SO2↑;
(3)由题给信息得知:硫代硫酸钠加热易分解,蒸干会使硫代硫酸钠脱水分解,由于溶液表面的温度较低,故晶膜通常在溶液表面出现,故答案为:蒸干会使硫代硫酸钠脱水并分解;因为溶液表面温度较低;
(4)硫代硫酸钠易溶于水,难溶于乙醇,据此选择的洗涤试剂为乙醇,乙醇的结构式为: ,故答案为:
,故答案为: ;
;
(5)在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失;
C、由于装置中存在压强差,所以为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验,
故选A、B、D;
(6)在锥形瓶中加入25mL 0.0lmol•L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+═3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-═2I-+S4O62-,
则可得关系式:IO3-~6S2O32-,
1mol 6mol
0.025L×0.0lmol•L-1 n(S2O32-)
则n(S2O32-)=0.0015mol,
第三次实验的数据误差较大,舍去,
所以250mL硫代硫酸钠溶液中硫代硫酸钠的物质的量为0.0015mol×$\frac{250}{(19.98+20.02)×\frac{1}{2}}$=0.01875mol,
则硫代硫酸钠的质量为0.01875mol×248g/mol=4.65g,
则该产品的纯度是$\frac{4.65}{5.0}$×100%=93%;
A.滴定管末用Na2S2O3溶液润洗,则Na2S2O3溶液会被稀释,所以测出硫代硫酸钠的质量偏小,故纯度偏小,故A选;
B.滴定终点时俯视读数,使Na2S2O3溶液体积偏小,计算出的硫代硫酸钠的质量偏大,故纯度偏大,故B不选;
C.锥形瓶用蒸馏水润洗,对实验结果没影响,纯度不变,故C不选;
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡,使读出的Na2S2O3的体积变小,计算出原溶液中的硫代硫酸钠的质量偏大,则纯度偏大,故D不选;
E.由于剧烈震荡锥形瓶,会导致待测液溅出,测定消耗的标准液体积减小,测定结果偏低,故答案为:93%;AE.
点评 本题通过制取Na2S2O3•5H2O的实验操作,考查了物质制备方案的设计、基本实验操作、离子方程式的书写、物质纯度的计算、滴定误差分析等,题目难度中等,明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 温室效应--CO2 | B. | 白色污染--废弃塑料 | ||
| C. | 酸雨--SO2 | D. | 雾霾--CO |
| A. | 在NaNO3和NaCl混合溶液:H+、NH4+、SO42-、Cu2+ | |
| B. | 加入金属镁能产生H2的溶液:Na+、SO42-、Cu2+、NO3- | |
| C. | 常温下由水电离出的c(OH-)=10-12mol/L的溶液:Na+、SO32-、Cl-、Mg2+ | |
| D. | pH=2的溶液中:ClO-、K+、CH2CHO、SO42- |
| A. | 1mol H2SO4的质量就是1个H2SO4分子的质量的98倍 | |
| B. | 水的摩尔质量是18g | |
| C. | 1mol任何物质都含有6.02×1023个原子 | |
| D. | 24g O2分子与24g O3分子所含的氧原子数相等 |

已知:FeTiO3+4H+=Fe2++TiO2++2H2O草酸(C2H2O4)具有很强还原性,易被氧化成二氧化碳
(1)化合物FeTiO3中铁元素的化合价是+2.
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为SiO2(填化学式).
(3)含TiO2+溶液乙转化生成TiO2的离子方程式是TiO2-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2↓+2H+.
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是20:9.
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为$\frac{cV×10{\;}^{-3}×M}{w}$×100%(用代数式表示).
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$2MgCl2+Ti,由TiCl4→Ti需要在Ar气中进行的理由是高温下Mg(Ti)会与空气中的O2(或CO2、N2)作用.反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于1412℃即可.
 25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+) | |
| B. | 25℃时K甲(CuS)约为1×10-35 | |
| C. | 向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-4mol•L-1的Na2S溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |

| A. | 装置用于检验溴丙烷消去产物 | B. | 装置用于测定乙醇的结构式 | ||
| C. | 装置用于提取I2的CCl4溶液中的I2 | D. | 装置用于除去甲烷中的乙烯 |
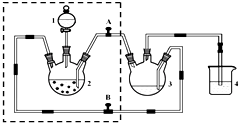 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: