题目内容
实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式如下:
MnO2+4HCl
MnCl2+Cl2↑+2H2O
(1)该反应属于氧化还原吗?如果是,指出其中的氧化剂和还原剂;如果不是,说明理由.
(2)密度为1.19g?cm-3、溶质的质量分数为36.5%的浓盐酸200mL,跟足量二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L.计算参加反应的浓盐酸的体积以及反应中被氧化的HCl的物质的量.
MnO2+4HCl
| ||
(1)该反应属于氧化还原吗?如果是,指出其中的氧化剂和还原剂;如果不是,说明理由.
(2)密度为1.19g?cm-3、溶质的质量分数为36.5%的浓盐酸200mL,跟足量二氧化锰发生反应,产生的氯气在标准状况下的体积为11.2L.计算参加反应的浓盐酸的体积以及反应中被氧化的HCl的物质的量.
分析:(1)Mn元素的化合价降低,Cl元素的化合价升高,为氧化还原反应;
(2)产生的氯气在标准状况下的体积为11.2L,n(Cl2)=
=0.5mol,c(HCl)=
=11.9mol/L,结合反应方程式计算.
(2)产生的氯气在标准状况下的体积为11.2L,n(Cl2)=
| 11.2L |
| 22.4L/mol |
| 1000×1.19×36.5% |
| 36.5 |
解答:解:(1)Mn元素的化合价降低,Cl元素的化合价升高,为氧化还原反应,氧化剂为MnO2,还原剂为HCl,
答:属于氧化还原反应,氧化剂为MnO2;还原剂为HCl.
(2)产生的氯气在标准状况下的体积为11.2L,n(Cl2)=
=0.5mol,c(HCl)=
=11.9mol/L,
由MnO2+4HCl
MnCl2+Cl2↑+2H2O可知,
被氧化的HCl的物质的量为0.5mol×2=1 mol,
浓盐酸的体积为
=0.168L=168mL,
答:参加反应的浓盐酸的体积为168mL,反应中被氧化的HCl的物质的量为1mol.
答:属于氧化还原反应,氧化剂为MnO2;还原剂为HCl.
(2)产生的氯气在标准状况下的体积为11.2L,n(Cl2)=
| 11.2L |
| 22.4L/mol |
| 1000×1.19×36.5% |
| 36.5 |
由MnO2+4HCl
| ||
被氧化的HCl的物质的量为0.5mol×2=1 mol,
浓盐酸的体积为
| 0.5mol×4 |
| 11.9mol/L |
答:参加反应的浓盐酸的体积为168mL,反应中被氧化的HCl的物质的量为1mol.
点评:本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及利用反应方程式计算的考查,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
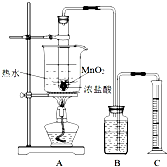 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.方法一:
甲同学利用图装置,测定盐酸浓度降至临界浓度时 反应生成氯气的体积,来探究在某温度下浓盐酸与二氧化锰反应的临界浓度.
方法:A中试管有足量的MnO2,往其中加入10mol/L的浓盐酸,控制温度为80℃进行反应.甲同学进行了三次同样的实验,收集气体(体积均换算成标准状况),数据如下表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
(1)请写出A中试管内反应的离子方程式
(2)检验该装置的气密性的方法是
(3)B中加入的溶液为
(4)为计算与二氧化锰反应的浓盐酸临界浓度,甲同学的第
方法二:
(5)乙同学认为该实验有不足之处:浓盐酸易挥发,会造成上述所测的临界浓度
乙同学提出可直接用反应后A中的溶液来测定盐酸的临界浓度:
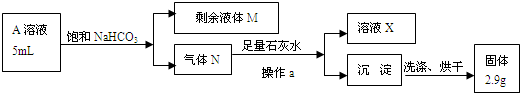
(6)以上图表中操作a的名称是
(7)请写出A溶液中的物质与NaHCO3溶液反应的离子方程式:
(8)根据以上数据,浓盐酸与二氧化锰制氯气的反应中浓盐酸的临界浓度为