题目内容
实验室常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式为MnO2+4HCl(浓)
| ||
. |
(1)浓盐酸中HCl的物质的量浓度.
(2)被氧化的HCl的物质的量.
分析:(1)根据c=
计算浓盐酸的物质的量浓度;
(2)发生反应MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O,被氧化的浓盐酸生成氯气,由氯元素守恒可知,被氧化的n(HCl)=2n(Cl2),据此计算.
| 1000ρw |
| M |
(2)发生反应MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O,被氧化的浓盐酸生成氯气,由氯元素守恒可知,被氧化的n(HCl)=2n(Cl2),据此计算.
解答:解:(1)浓盐酸的物质的量浓度为
mol/L=11.9mol/L,
答:该浓盐酸的物质的量浓度为11.9mol/L;
(2)发生反应MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O,被氧化的浓盐酸生成氯气,氯气的物质的量为
=0.25mol,由氯元素守恒可知,被氧化的n(HCl)=2n(Cl2)=0.25mol×2=0.5mol,
答:反应中被氧化的HCl的物质的量为0.5mol.
| 1000×1.19×36.5% |
| 36.5 |
答:该浓盐酸的物质的量浓度为11.9mol/L;
(2)发生反应MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O,被氧化的浓盐酸生成氯气,氯气的物质的量为
| 5.6L |
| 22.4L/mol |
答:反应中被氧化的HCl的物质的量为0.5mol.
点评:本题考查物质的量浓度、氧化还原反应的计算等,难度不大,注意氧化还原反应中守恒的计算.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
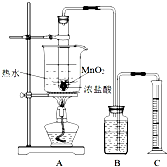 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.方法一:
甲同学利用图装置,测定盐酸浓度降至临界浓度时 反应生成氯气的体积,来探究在某温度下浓盐酸与二氧化锰反应的临界浓度.
方法:A中试管有足量的MnO2,往其中加入10mol/L的浓盐酸,控制温度为80℃进行反应.甲同学进行了三次同样的实验,收集气体(体积均换算成标准状况),数据如下表:
| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
(1)请写出A中试管内反应的离子方程式
(2)检验该装置的气密性的方法是
(3)B中加入的溶液为
(4)为计算与二氧化锰反应的浓盐酸临界浓度,甲同学的第
方法二:
(5)乙同学认为该实验有不足之处:浓盐酸易挥发,会造成上述所测的临界浓度
乙同学提出可直接用反应后A中的溶液来测定盐酸的临界浓度:
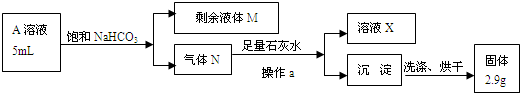
(6)以上图表中操作a的名称是
(7)请写出A溶液中的物质与NaHCO3溶液反应的离子方程式:
(8)根据以上数据,浓盐酸与二氧化锰制氯气的反应中浓盐酸的临界浓度为