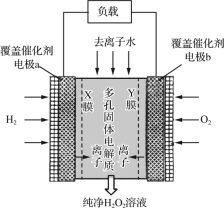
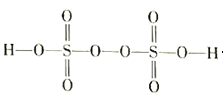
��Ŀ����
����Ŀ��ij��ú��ʯ��Ԥ��������Ҫ��SiO2��61%����Al2O3��30%����������Fe2O3��FeO����þ�Ļ�����ȡ�ijʵ��С����������ȡAl(OH)3
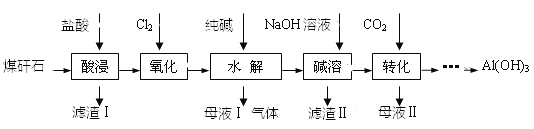
��1��������������з�������Ҫ��Ӧ�����ӷ���ʽΪ_______________��
��2������������Ŀ����_____________������Fe3+�ķ�����______________��
��3������I����Ҫ�ɷ�________��������ķ�Ӧ����ʽ______________��
��4������ת����ʱ��Ҫ��Ӧ�����ӷ���ʽΪ_________________________________��
���𰸡�Al2O3��6H+=2Al3+��3H2O ��Fe2+������Fe3+����������ˮ���ȥ��Ԫ�� ȡ��������Һ���Թ��У��μ�KSCN��Һ������Һ����Ѫ��ɫ����֤����Fe3+ SiO2 SiO2+4HF=SiF4��+2H2O AlO2-��CO2��2H2O=Al(OH)3����HCO3-����2AlO2-��CO2��3H2O=2Al(OH)3����CO32-��
��������
ú��ʯ����ϡ���ᷢ���ķ�Ӧ��![]() ��
��![]() ��
��![]() ��Ȼ����ˣ��õ�������IΪSiO2������Һ��ͨ�������������ķ�ӦΪ
��Ȼ����ˣ��õ�������IΪSiO2������Һ��ͨ�������������ķ�ӦΪ![]() ������Һ�м���̼���ƣ������ķ�ӦΪ
������Һ�м���̼���ƣ������ķ�ӦΪ![]() ��
��![]() ��
��![]() ��
��![]() �����˵õ�����Һ�к���NaCl���������м������NaOH��Һ��Al��OH��3�ܽ⣬����������ܽ⣬���˺�õ�������IIΪCaCO3��Mg��OH��2��Fe��OH��3����Һ�к���NaAlO2������Һ��ͨ�������̼�������ķ�ӦΪ
�����˵õ�����Һ�к���NaCl���������м������NaOH��Һ��Al��OH��3�ܽ⣬����������ܽ⣬���˺�õ�������IIΪCaCO3��Mg��OH��2��Fe��OH��3����Һ�к���NaAlO2������Һ��ͨ�������̼�������ķ�ӦΪ![]() ����
����![]() ����Ȼ����˵õ�Al��OH��3����ҺII�к���NaHCO3��̼���ƣ��ݴ˷������
����Ȼ����˵õ�Al��OH��3����ҺII�к���NaHCO3��̼���ƣ��ݴ˷������
��1����������н��������ﶼ��ϡ���ᷴӦ�����Ȼ����Ҫ���ӷ�Ӧ����ʽΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��2����������ˮ�����ɳ�������Ҫ��pH��С����Fe2+������Fe3+����������ˮ���ȥ��Ԫ�أ���������KSCN��Һ���飬����鷽���ǣ�ȡ����ĸҺ�μ�KSCN��Һ����Ѫ��ɫ����Fe3+��ˮ����ȫ��
�ʴ�Ϊ����Fe2+������Fe3+����������ˮ���ȥ��Ԫ�أ�ȡ��������Һ���Թ��У��μ�KSCN��Һ������Һ����Ѫ��ɫ����֤����Fe3+��
��3��ͨ�����Ϸ���֪������I�ijɷ�ΪSiO2��SiO2ֻ�ܺ�HF������Ӧ![]() �ʴ�Ϊ��SiO2��
�ʴ�Ϊ��SiO2��![]() ��
��
��4��ͨ�����Ϸ���֪��ת��ʱ���������ӷ�Ӧ����ʽΪ![]() ����
����![]() �����ʴ�Ϊ��
�����ʴ�Ϊ��![]() ����
����![]() ����
����

 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д� ����ν����Ž̲��㽭���̴�ѧ������ϵ�д�
����ν����Ž̲��㽭���̴�ѧ������ϵ�д� �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�����Ŀ��ij�����ͬѧ����ϡ������п��ȡ������ʵ�飬��ش��������⣺
��1����ͬѧ���ּ�����������ͭ��Һ�ɼӿ��������������ʡ�Ϊ�˽�һ���о�����ͭ�����������������ʵ�Ӱ�죬���������һϵ��ʵ�顣�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���ķ�Ӧƿ�У��ռ����������壬��¼�����ͬ�������������ʱ�䡣
������������ʵ�� �����Һ���������� | A | B | C | D | E | F |
4 mol��L��1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
����CuSO4��Һ/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
������ɴ�ʵ����ƣ����У�V1��___��V6��___��V9��___��
�ڷ�Ӧһ��ʱ���ʵ��A�еĽ�����___ɫ��ʵ��E�еĽ�����___ɫ��
�۸�ͬѧ���ó��Ľ���Ϊ������������CuSO4��Һʱ���������������ʻ�����ߡ����������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ��___________________________��
��2����ͬѧΪ��̽��п��ϡ���ᷴӦ�����е����ʼ������ı仯����������ʵ�飬����Ӱ�췴Ӧ���ʵ����ء�
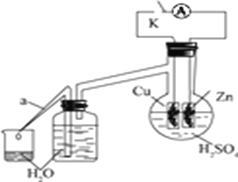
ʵ��ʱ���ӶϿ�K��ʼ��ÿ���1���ӣ�����Ͽ���պ�K������������ÿ1�����ڴ�a��������ˮ�������õ���ˮ�������±���ʾ��
1����ˮ�������Ͽ�K�� | 34 | 59 | 86 | 117 | �� | 102 |
1����ˮ�������պ�K�� | 58 | 81 | 112 | 139 | �� | 78 |
������Ӧ�����е�ˮ��������ش�
�� ��ˮ����58��34��81��59��˵���ڷ�Ӧ���ڣ��պ�Kʱ�ȶϿ�Kʱ�ķ�Ӧ���ʿ죬��Ҫԭ����__________________________________________________________��
�� ��ˮ����102��78��˵���ڷ�Ӧ���ڣ��Ͽ�Kʱ�ķ�Ӧ���ʿ��ڱպ�Kʱ�ķ�Ӧ���ʣ���Ҫԭ����____________________________________��