题目内容
 一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)??2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x.根据以上条件,回答下列问题:
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)??2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x.根据以上条件,回答下列问题:(1)一段时间后上述反应达到平衡,则下列说法中正确的是
A.物质A、B的转化率之比为1:2
B.当2v正(A)=v逆(B)时,反应一定达到平衡状态
C.起始时刻和达到平衡后容器中的压强之比为3n:(3n-nx)
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
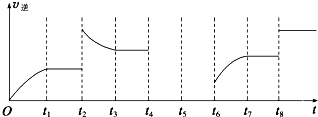
(3)该反应的逆反应速率与时间的关系如图所示.
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时
②t2时平衡向
考点:化学平衡的影响因素
专题:
分析:(1)平衡状态的判断依据是正逆反应速率相等,各组分的浓度保持不变,据此判断;
(2)依据化学平衡是哪段是列式计算平衡浓度,结合平衡常数概念计算得到平衡常数,保证A浓度不变的情况下,增大容器的体积,BC浓度减小比例相同此时浓度商和平衡常数相同,平衡不动;
(3)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,t8时正逆反应速率都增大且平衡不移动;
②t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,据此分析解答.
(2)依据化学平衡是哪段是列式计算平衡浓度,结合平衡常数概念计算得到平衡常数,保证A浓度不变的情况下,增大容器的体积,BC浓度减小比例相同此时浓度商和平衡常数相同,平衡不动;
(3)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,t8时正逆反应速率都增大且平衡不移动;
②t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,据此分析解答.
解答:
解:(1)平衡状态的判断依据是正逆反应速率相等,各组分的浓度保持不变,
A、反应物A与B加入的反应物的物质的量之比等于其化学计量数之比,所以平衡后A与B的转化率之比等于化学计量数之比为1:2,故A正确;
B、当2v正(A)=v逆(B)时,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、转化率为x,则平衡后有A、B、C物质的量分别为n-nx、2n-nx、2nxmol,平衡后气体总物质的量为3n-nx,恒容容器中,气体物质的量之比等于其压强之比,故C正确;
D、恒容容器中,充入惰性气体(如Ar),平衡不移动,故D错误;
故选ABC;
(2)在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)
2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x,
A(g)+2B(g)
2C(g)
起始量(mol) n 2n 0
变化量(mol) nx 2nx 2nx
平衡量(mol) n-nx 2n-2nx 2nx
平衡浓度为,c(A)=
mol/L,c(B)=
mol/L,c(C)=
mol/L
平衡常数K=
=
=
,
增大容器体积时,c(B)和c(C)等比例减小,由于A的浓度不变,此时
的值仍然等于K,所以平衡不移动;
故答案为:
;C;
(3)由于纵坐标只表示v逆,为了便于求解,在解题时可把v正补上,t2时平衡逆向移动,采用的条件可以是升温或增大C的浓度;t8时平衡不移动,采用的条件是使用了催化剂.
①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度,t8时平衡不移动,采用的条件是使用了催化剂.
故答案为:增大生成物C浓度或升高温度;使用催化剂;
②t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,故答案为:逆反应.
A、反应物A与B加入的反应物的物质的量之比等于其化学计量数之比,所以平衡后A与B的转化率之比等于化学计量数之比为1:2,故A正确;
B、当2v正(A)=v逆(B)时,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、转化率为x,则平衡后有A、B、C物质的量分别为n-nx、2n-nx、2nxmol,平衡后气体总物质的量为3n-nx,恒容容器中,气体物质的量之比等于其压强之比,故C正确;
D、恒容容器中,充入惰性气体(如Ar),平衡不移动,故D错误;
故选ABC;
(2)在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g)
| ||
A(g)+2B(g)
| ||
起始量(mol) n 2n 0
变化量(mol) nx 2nx 2nx
平衡量(mol) n-nx 2n-2nx 2nx
平衡浓度为,c(A)=
| n-bx |
| V |
| 2n-2nx |
| V |
| 2nx |
| V |
平衡常数K=
| [C]2 |
| [A]?[B]2 |
(
| ||||
|
| x2V |
| n(1-x)3 |
增大容器体积时,c(B)和c(C)等比例减小,由于A的浓度不变,此时
| [C]2 |
| [A]?[B]2 |
故答案为:
| x2V |
| n(1-x)3 |
(3)由于纵坐标只表示v逆,为了便于求解,在解题时可把v正补上,t2时平衡逆向移动,采用的条件可以是升温或增大C的浓度;t8时平衡不移动,采用的条件是使用了催化剂.
①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度,t8时平衡不移动,采用的条件是使用了催化剂.
故答案为:增大生成物C浓度或升高温度;使用催化剂;
②t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,故答案为:逆反应.
点评:本题考查了化学平衡常数的确定、外界条件对反应速率的影响等知识点,注意反应前后气体体积不变的可逆反应中,压强对能改变反应速率但不影响平衡的移动,图象绘制平衡影响因素的变化,题目难度中等.

练习册系列答案
相关题目
酒精不能发生的反应是( )
| A、加成反应 | B、氧化反应 |
| C、取代反应 | D、酯化反应 |
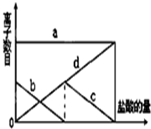 少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A、a:Cl-b:K+ c:CO32- d:HCO3- |
| B、a:K+ b:CO32- c:Cl- d:HCO3- |
| C、a:K+ b:CO32- c:HCO3- d:Cl- |
| D、a:K+b:HCO3- c:Cl- d:CO32- |
在恒容密闭容器中进行的反应:2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g)△H.在某压强下起始时按不同氢碳比[
]投料(如图中曲线①②③),测得CO2的平衡转化率与温度关系如图所示,下列有关说法正确的是( )

| n(H2) |
| n(CO2) |

| A、该反应:△H>0 |
| B、氢碳比:①<②<③ |
| C、其它条件不变的情况下,缩小容器的体积可提高CO2的转化率 |
| D、若起始CO2浓度为2mol?L-1、H2为4mol?L-1,在图中曲线③氢碳比条件下进行,则400K时该反应的平衡常数数值约为1.7 |
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
| A、AgCN难溶于水 |
| B、MnO2不能与HCN反应生成(CN)2 |
| C、HCN易形成白雾 |
| D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,含有NA个氦原子的氦气的体积约为11.2L |
| B、标准状况下,44.8L H2O的分子数为2NA |
| C、常温常压下,22g CO2含有原子总数为1.5NA |
| D、含有1mol HCl 的稀盐酸与足量的铁发生反应,转移的电子总数为2NA |
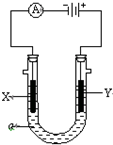 (1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是