题目内容
6.将AgCl分别投入下列溶液中:①20mL 0.1mol/L(NH4)2CO3溶液 ②40mL 0.03mol/L HCl
③50mL 0.03mol/L AgNO3溶液 ④30mL 0.02mol/L CaCl2溶液
⑤10mL蒸馏水 ⑥30mL 0.02mol/L NH4NO3溶液.
AgCl的溶解度由大到小排列的顺序是①>⑥>⑤>②=③>④.
分析 AgCl饱和溶液中存在AgCl(aq)?Ag+(aq)+Cl-(aq),当溶液中存在c(Ag+)或c(Cl-)对溶解平衡有抑制作用,当溶液中存在能与Ag+或Cl-反应的离子则会促进溶解平衡正移,从平衡移动的角度分析.
解答 解:AgCl在溶液中存在溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),由于c(Ag+)或c(Cl-)对溶解平衡有抑制作用,则溶液中c(Ag+)或c(Cl-)越大,则AgCl的溶解度越小;
①和⑥中铵根离子水解生成NH3•H2O,Ag+与NH3•H2O结合,使溶解平衡正移,AgCl的溶解度增大,由于(NH4)2CO3中NH4+水解程度大,则NH3•H2O的浓度大,使溶解平衡正移的程度大,则①>⑥;
当溶液中存在c(Ag+)或c(Cl-)对溶解平衡有抑制作用,
②c(Cl-)=0.03mol/L,③c(Ag+)=0.03mol/L,④c(Cl-)=0.04mol/L,⑤c(Ag+)或c(Cl-)为0,
则AgCl的溶解度由大到小排列顺序是:⑤>②=③>④,
综上可知AgCl的溶解度由大到小排列顺序是:①>⑥>⑤>②=③>④,
故答案为:①>⑥>⑤>②=③>④.
点评 本题考查难溶电解质的溶解平衡,题目难度不大,注意影响平衡移动的因素,需要理清的是离子浓度大小与难溶电解质的溶解度的关系.

练习册系列答案
相关题目
1.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L.min).平衡时H2的转化率为50%.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2B.v(N2)正=3v(H2)逆
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2.当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则该反应的v(N2)正> v(N2)逆(填“<”“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol.则前5分钟的平均反应速率v(N2)=0.01mol/(L.min).平衡时H2的转化率为50%.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”“>”或“=”);
②下列各项能作为判断该反应达到化学平衡状态的依据是C(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2B.v(N2)正=3v(H2)逆
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2.当测得NH3、N2和H2物质的量分别为3mol、2mol和 1mol时,则该反应的v(N2)正> v(N2)逆(填“<”“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
11.下列物质属于能导电的强电解质的是( )
| A. | 醋酸 | B. | 氯化钠溶液 | C. | 乙醇 | D. | 熔融的硫酸钡 |
18.下列物质的稀溶液中,除水分子外,存在其它分子的是( )
| A. | NaCl | B. | NaOH | C. | HNO3 | D. | HClO |
15.在无土裁培中,配制1L含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为( )
| A. | 0.40mol 0.50mol 0.12mol | B. | 0.66mol 0.50mol 0.24mol | ||
| C. | 0.64mol 0.50mol 0.24mol | D. | 0.64mol 0.02mol 0.24mol |
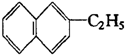 属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10).
属于萘的同系物,则萘和萘的同系物分子组成通式为CnH2n-12 (n≥10). ②丙的结构简式为
②丙的结构简式为 .
.