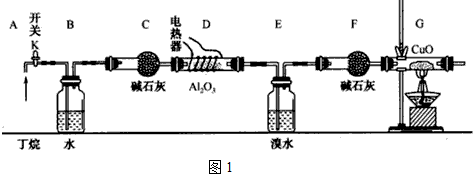
题目内容
10.为实现实验目的,其它主要仪器、试剂及需要在某个部位放置温度计合理的是( )| 选项 | 实验目的 | 玻璃实验仪器 | 实验试剂 | 温度计位置 |
| A | 制取乙烯 | 圆底烧瓶、集气瓶、导气管、酒精灯 | 浓硫酸、乙醇 | 反应液中 |
| B | 提纯乙醇 | 蒸馏烧瓶、冷凝管、锥形瓶、承接管 | 75%的乙醇 | 支气管口 |
| C | 中和热测定 | 烧杯、环形玻璃搅拌棒 | 氢氧化钠、醋酸 | 酸、碱及反应液中 |
| D | 制银镜 | 烧杯、试管、酒精灯 | 银氨溶液、葡萄糖 | 水浴的烧杯水中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.制取乙烯,为固液反应且加热装置,实验需要测定反应液的温度为170℃;
B.提纯乙醇,选蒸馏装置,实验测定馏分的温度;
C.中和热测定,选稀的强酸、强碱,实验测定起始酸、碱的温度及反应的最高温度;
D.制银镜,选水浴加热装置,该实验在碱性条件下进行.
解答 解:A.制取乙烯,为固液反应且加热装置,试剂及仪器均合理,实验需要测定反应液的温度为170℃,则温度计的水银球在反应液中,故A正确;
B.提纯乙醇,选蒸馏装置,仪器中缺少酒精灯,试剂还需要CaO,实验测定馏分的温度,温度计的水银球在支气管口,故B错误;
C.中和热测定,选稀的强酸、强碱,实验测定起始酸、碱的温度及反应的最高温度,醋酸为弱酸,则试剂选择不合理,故C错误;
D.制银镜,选水浴加热装置,该实验在碱性条件下进行,则试剂缺少碱性试剂,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、混合物分离提纯及中和热测定、银镜反应实验等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
20.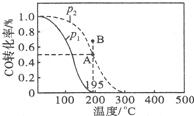 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
①O~3min,平均速率V(CH3OH)=0.033mol/(L.min),Q<0(填“<”“=”或“>”).
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH.写出相应反应的化学方程式:2CH3OH→HCOOCH3+2H2↑、HCOOCH3→CH3OH+CO↑.
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇.已知:
光催化制氢:2H2O(1)=2H2(g)+O2(g)△H=+571.5kJ•mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H2O(1)△H=一137.8kJ•mol-1
则反应:2H2O(1)+CO2(g)=CH30H(l)+3/202(g)的△H=+719.45 kJ•mol-1
(3)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如图所示,P2及195℃时n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,压强P2平衡时CO的转化率更大,而正反应为气体体积减小的反应,增大压强平衡向正反应方向移动,CO的转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
1.下列有关化学用语的各种表示正确的是( )
| A. | 电子式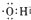 可以表示烃基,也可以表示氢氧根离子 可以表示烃基,也可以表示氢氧根离子 | |
| B. | 磷原子的简化电子排布式:[He]3s23p3 | |
| C. | 聚丙烯链节的结构简式为:-CH2-CH-CH2- | |
| D. | 用惰性电极电解MgCl2溶液的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓ |
5.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )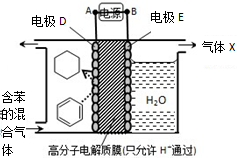

| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电极→B |
15.化学与生活息息相关,下列说法错误的是( )
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
2.背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
19.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,充电时,总反应为Na2Sx═2Na+xS(3<x<5),其反应原理如图所示,下列说法错误的是( )


| A. | 放电时,电极A为负极 | |
| B. | 该电池工作的适宜温度应控制10℃左右 | |
| C. | 放电时,内电路中Na+的移动方向为A到B | |
| D. | 充电时,阳极的电极反应式为 Sx2--2e-═xS |
20.下列有机化学方程式书写正确的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl1+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3CH2OH+CH3OOH$\stackrel{浓硫酸}{→}$CH3COOCH2CH3 |