题目内容
19.金属元素在现代工业中也占据极其重要的地位,钛被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大特点,是理想化工设备材料.(1)基态钛原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2.化合物乙的沸点明显高于化合物甲,主要原因是化合物乙能形成分子间氢键.化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为O>N>C.
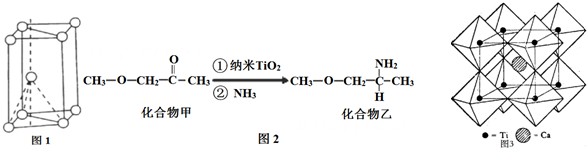
(3)钙钛矿晶体的结构如图3所示.假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被6个氧离子包围.
分析 (1)核外电子没有运动状态相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
(2)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大;
(3)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子.
解答 解:(1)Ti原子核外电子数为22,核外共有22种运动状态不相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
故答案为:22;六方最密;
(2)化合物乙因分子间存在氢键,则化合物乙的沸点比化合物甲高,化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:化合物乙分子间形成氢键;O>N>C;
(3)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围
故答案为:6.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、氢键、晶胞结构与计算等,需要显示具备一定的空间想象与数学计算能力.

练习册系列答案
相关题目
10.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 22.4 L O2和O3的混合气中氧原子数为0.2NA | |
| B. | 标准状况下,22.4 L苯的分子数为NA | |
| C. | 46 g乙醇中含有的共价键总数为8 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
7.唐末五代时期丹学著作《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手面及烬屋舍者”.描述的是( )的制作过程.
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
14.A,B,C,D,E为前四周期中原子序数依次增大的元素,相关的信息如下:
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种分子式为A2H4的化合物,该分子中存在σ键和π键数目比为5:1,A的杂化类型为sp2.
(2)A,B,D,E的氢化物中沸点最高的是H2O(写化学式),A,B,F的第一电离能由大到小的顺序时N>O>C.
(3)E位于周期表中的位置是第四周期第IB族,E的基态原子的核外电子排布式为1s22s22p63s23p63d104s1.
(4)根据下列能量变化示意图1,请写出BO和AO2反应的热化学方程式NO(g)+CO2(g)=NO2(g)+CO(g)△H=+234kJ/mol
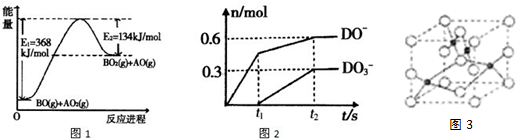
(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为离子键和共价键,将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示,请写出t2时刻总反应的化学方程式5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.
(6)下图是E和F形成的化合物的晶胞结构示意图3,可确定该化合物的化学式为CuO,若该晶胞的棱长为apm,则该晶胞的密度为$\frac{320}{(a×1{0}^{-10})^{3}{N}_{A}}$g/cm3.
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是空气中含量最丰富的元素 |
| C | 短周期元素中,C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
| F | 最外层电子数为次外层的3倍 |
(1)A与氢可形成一种分子式为A2H4的化合物,该分子中存在σ键和π键数目比为5:1,A的杂化类型为sp2.
(2)A,B,D,E的氢化物中沸点最高的是H2O(写化学式),A,B,F的第一电离能由大到小的顺序时N>O>C.
(3)E位于周期表中的位置是第四周期第IB族,E的基态原子的核外电子排布式为1s22s22p63s23p63d104s1.
(4)根据下列能量变化示意图1,请写出BO和AO2反应的热化学方程式NO(g)+CO2(g)=NO2(g)+CO(g)△H=+234kJ/mol

(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为离子键和共价键,将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示,请写出t2时刻总反应的化学方程式5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.
(6)下图是E和F形成的化合物的晶胞结构示意图3,可确定该化合物的化学式为CuO,若该晶胞的棱长为apm,则该晶胞的密度为$\frac{320}{(a×1{0}^{-10})^{3}{N}_{A}}$g/cm3.
4.CH4分子是以碳原子为中心的正四面体结构而不平面结构,理由是( )
| A. | CH3Cl只存在一种空间结构 | |
| B. | CH2Cl2只存在一种空间结构 | |
| C. | CHCl3只存在一种空间结构 | |
| D. | CH4的四个价键的键角和键长都相等 |
11.下列说法中正确的是( )
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 植物油和矿物油都是碳氢化合物 | |
| C. | 光导纤维维、合成纤维和玻璃纤维都是新型无机非金属材料 | |
| D. | 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程 |
12.下列说法正确的是( )
| A. | 常温下可用铁制容器来盛装浓硫酸、说明常温下铁与浓硫酸不反应 | |
| B. | 同一元素的各种同位素的物理性质不同、化学性质相同 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 取碘水于试管中,加入汽油振荡后静置,其现象为下层呈紫红色 |