题目内容
16.下列化学用语正确的是( )| A. | 甲烷的球棍模型: | |
| B. | NH3的电子式: | |
| C. | H、${\;}_{\;}^{1}$H、${\;}_{\;}^{2}$H、${\;}_{\;}^{3}$H互为同位素 | |
| D. | 融融状态下NaSO4的离子方程式为NaHSO4═Na++HSO4- |
分析 A、甲烷分子中,C的原子半径大于H原子;
B、氮原子的最外层有5个电子;
C、同种元素的不同种原子间互称同位素;
D、熔融状态下共价键不能断裂.
解答 解:A、球棍模型表现原子间的连接与空间结构,甲烷分子式为CH4,C原子形成4个C-H,为正四面体结构,碳原子半径大于氢原子半径,球棍模型为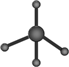 ,故A错误;
,故A错误;
B、氨气有3个氢原子和1个氮原子分别共用1对电子形成,电子式为: ,故B错误;
,故B错误;
C、同种元素的不同种原子间互称同位素,故${\;}_{\;}^{1}$H、${\;}_{\;}^{2}$H、${\;}_{\;}^{3}$H互为同位素,但H表示所有种类的氢原子,不是哪种具体的氢原子,故不是同位素,故C错误;
D、熔融状态下离子键能断裂,而共价键不能断裂,故融状态下NaHSO4的离子方程式为NaHSO4═Na++HSO4-,故D正确.
故选D.
点评 本题考查考查常用化学用语的书写,为高频考点,题目难度不大,把握化学用语的规范应用是解答的关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
相关题目
6.将15g CH4和 C2H4 的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4和 C2H4的体积比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 2:3 |
7.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )


| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中无明显现象 |
4. 可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂.
 可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂.
| A. | ⑤ | B. | ②④ | C. | ②⑤ | D. | ②③ |
11.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

| A. | 原子半径:Z>Y>X. | |
| B. | X和Z形成的化合物能溶于苛性钠溶液 | |
| C. | R元素的含氧酸酸性-定强于W元素的含氧酸的酸性 | |
| D. | Y和W形成的化合物,阴阳离子的个数比可能为1:1 |
8.关于元素周期表,下列叙述中正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在主族元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素 | |
| C. | 在过渡元素区域可以寻找制备新型农药材料的元素 | |
| D. | 非金属性最强的元素在元素周期表的最右上角 |
6.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 标准状况下,11.2L CH2Cl2中含有的原子数为2.5NA | |
| C. | 1.68g Fe 与足量高温水蒸气反应,转移电子数为0.09NA | |
| D. | 17g H2O2所含非极性键数目为0.5NA |