题目内容
19.相同质量的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,二者比较,相等的是( )①铜片消耗完所需时间 ②反应中氧化剂得到电子的总数
③反应生成气体的体积(同温、同压) ④反应后溶液中铜离子浓度.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①、硝酸浓度不同反应速率不同;
②、铜与过量硝酸反应,硝酸得到电子等于铜失去的电子;
③、铜和浓硝酸反应生成二氧化氮气体,和稀硝酸反应生成一氧化氮,铜失电子相同,生成气体不同体积不同;
④、反应后铜离子物质的量相同,溶液体积相同,所以浓度相同.
解答 解:①、硝酸浓度不同反应速率不同,铜片消耗完所需时间不同,故①不符合;
②、铜与过量硝酸反应硝酸得到电子等于铜失去的电子,反应中氧化剂得到电子的总数相同,故②符合;
③、铜和浓硝酸反应生成二氧化氮气体,和稀硝酸反应生成一氧化氮,铜失电子相同,生成气体不同,体积不同,故③不符合;
④、反应后铜离子物质的量相同,溶液体积相同,所以浓度相同,故④符合;
故选B.
点评 本题考查了硝酸性质,氧化还原反应电子转移计算分析判断,注意硝酸浓度不同生成气体不同,题目难度中等.

练习册系列答案
相关题目
9.肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1 076.7 kJ/mol |
10.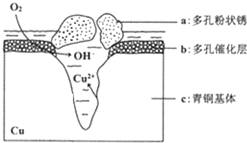 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义. 右图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.下列说法不正确的是( )| A. | 腐蚀过程中,负极是a | |
| B. | 正极反应是 O2+4e-+2H2O═4OH- | |
| C. | 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) | |
| D. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ |
7.若在标准状况下,将a L HCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为( )
| A. | $\frac{36.5a}{22.4(a+1)d}$ | B. | $\frac{1000ad}{36.5a+22.4}$ | ||
| C. | $\frac{ad}{36.5a+22400}$ | D. | $\frac{1000ad}{36.5a+22400}$ |
14.用2-丙醇为有机原料制取1,2-丙二醇,其各步反应所属的反应类型是( )
| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→还原 |
4.次磷酸盐可用于化学镀铜,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2++X-→PO43-+Cu+H2O(未配平),下列有关说法正确的是( )
| A. | 该反应中次磷酸根离子得电子,表现还原性 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层 | |
| D. | 该反应每消耗3 mol X-,转移电子的物质的量为2 mol |
11.下列反应中,属于取代反应的是( )
| A. | CH4+2 O2 $\stackrel{点燃}{→}$ CO2+2H2O | |
| B. | CH2=CH2+H2 $\stackrel{催化剂}{→}$ CH3-CH3 | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ +HBr +HBr | |
| D. | 2CH3CH2OH+O2 $→_{△}^{Cu或Ag}$ 2CH3CHO+2 H2O |
8. 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1> K2(填“>”、“=”或“<”).
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.
 合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.
合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g)△H<0 具有重要的意义.(1)①该反应的化学平衡常数表达式是K=$\frac{[NH{\;}_{3}]^{2}}{[N{\;}_{2}][H{\;}_{2}]{\;}^{3}}$.
②该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
③理论上,为了增大平衡时H2的转化率,可采取的措施是a、d.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)═CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的 $\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)═CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO):n (H2O):n (CO2):n (H2)=1:16:6:6.