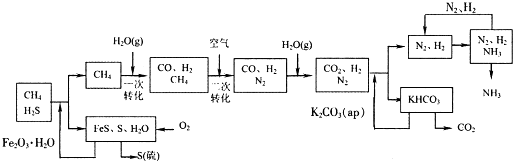
题目内容
某氮气,氢气混合气体对氦气的相对密度是1.8,取0.5mol该混合气,在固定体积的反应器中进行合成氨反应,当平衡时压强是反应前压强的0.8倍时,计算平衡混合气中氨气的体积分数.
答案:25%
解析:
提示:
解析:
|
本题合成氨的化学反应为
依据起始物氮气,氢气混合气体对氦气的相对密度是1.8,可以算出混合气的平均相对分子质量为: 1.8×4=7.2 再根据
由此可知
起始(mol) 0.1 0.4 0 转化(mol) x 3x 2x 平衡(mol) 依据平衡时压强是反应前压强的0.8倍,可列出如下比例式:
氨气的体积分数为
|
提示:
|
找出 |

练习册系列答案
相关题目

 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=