题目内容
1. 锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题:
锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题:(1)锌在周期表中位置为第四周期第ⅡB族_.
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液.
①写出氢氧化锌溶于氨水的离子方程式Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-.
②以下作用力在[Zn(NH3)4]SO4晶体中存在的有ABD.
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.范德华力 F.金属键
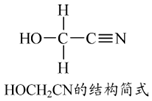
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
①HOCH2CN分子中碳原子轨道的杂化类型是sp3杂化、sp杂化.
②与H2O分子互为等电子体的阴离子为NH2-.
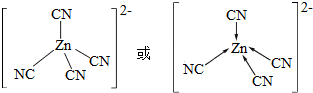
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键.不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
 .
.
分析 (1)Zn是30号元素,其原子核外有30个电子,元素的能层数等于其周期数,从第ⅢB族到第ⅥB族,其价层电子数等于其族序数,第ⅠB族、第ⅡB族,其最外层电子数等于其族序数;
(2)①氢氧化锌能溶于氨水,生成Zn(NH3)42-;
②非金属元素原子之间易形成共价键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,金属键存在于金属单质中,以此来解答;
(3)①根据价层电子对=σ 键电子对+中心原子上的孤电子对判断,注意三键含有1个σ键和2个π键;
②原子个数相等、价电子数相等的微粒为等电子体;
③[Zn(CN)4]2-中锌离子提供空轨道,C原子提供电子对形成配位键.
解答 解:(1)Zn是30号元素,其原子核外有30个电子,根据构造原理书写其核外电子排布式为1s22s22p63s23p63d104s2 或[Ar]3d104s2 ,核外有四层电子,所以属于第四周期,原子的外围电子排布为3d104s2 ,属于ⅡB族,
故答案为:第四周期第ⅡB族;
(2)①锌其氢氧化物既能溶于强酸,又能溶于强碱、弱碱.溶解氢氧化锌的原理与制取银铵溶液相似,反应的离子方程式为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-,
故答案为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH-;
②在[Zn(NH3)4]SO4晶体中由配离子与硫酸根离子的离子键,硫氧、氮氢之间的极性共价键,锌离子和氨气之间的配位键,无非极性共价键、范德华力、金属键,
故答案为:ABD;
(3)① ,其中与羟基(-OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为SP3,另外一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,价层电子对=2+$\frac{4-4×1}{2}$=2,所以碳原子杂化轨道类型为SP,
,其中与羟基(-OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为SP3,另外一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,价层电子对=2+$\frac{4-4×1}{2}$=2,所以碳原子杂化轨道类型为SP,
故答案为:sp3杂化、sp杂化;
②原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒该是3原子最外层电子数为8的分子或离子,这样的微粒有:H2S、NH2-,阴离子为:NH2-,
故答案为:NH2-;
③[Zn(CN)4]2-中锌离子提供空轨道,C原子提供电子对形成配位键,结构示意图表示为: ,图示箭头表示碳提供电子给锌,
,图示箭头表示碳提供电子给锌,
故答案为: .
.
点评 本题考查物质结构和性质,涉及元素在周期表中位置、σ键的数目、杂化理论的应用、等电子体、配位键等知识点,知道配位键的表示方法是解答的易错点,难点是HOCH2CN分子中碳原子轨道的杂化判断,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 铅蓄电池放电时的负极和充电时的阳极均发生在原反应 | |
| C. | 水解NH4++H2O?NH3•H2O+H+反应达到平衡后,升高温度平衡逆向移动 | |
| D. | 等体积、等物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
①乙烯、聚氯乙烯和苯分子中均含有碳碳双键
②苯、油脂均不能使酸性KMnO4溶液褪色
③氯苯分子中所有原子都处于同一平面
④甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种.
⑤一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
⑥

⑦一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g
其中全部不正确的是( )
| A. | ①③⑥⑦ | B. | ③④⑤⑥ | C. | ①②④⑤ | D. | ①⑤⑥⑦ |
| A. | NaOH是只含离子键的离子化合物 | |
| B. | HCl溶于水没有破坏共价键 | |
| C. | 碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 | |
| D. | 在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成 |
 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂lmolN-N吸收167kJ热量,生成1mol N≡N放出945kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于由非极性键构成的极性分子 | |
| B. | 氮元素非金属性比磷强,可知N4沸点比P4(白磷)高 | |
| C. | lmol N4气体转变为N2气体放出888kJ热量 | |
| D. | N4与N2互为同位素 |
| A. | 与H2化合时X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 在氧化还原反应中,甲失的电子比乙多 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
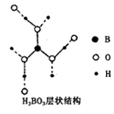 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |
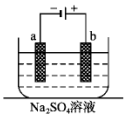 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )| A. | 电子的流向:负极→a电极→b电极→正极 | |
| B. | a电极附近呈蓝色,b电极附近呈红色 | |
| C. | 逸出气体的体积,a电极的大于b电极的 | |
| D. | Na+向a极移动 |
 A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.
A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同.