题目内容
11.40mL2mol/L的HNO3溶液中,含有HNO3的质量是多少?分析 根据n=cV计算出40mL2mol/L的HNO3溶液中含有硝酸的物质的量,然后根据m=nM计算出含有硝酸的质量.
解答 解:40mL2mol/L的HNO3溶液中含有硝酸的物质的量为:n(HNO3)=2mol/L×0.04L=0.08mol,该硝酸的质量为:m(HNO3)=63g/mol×0.08mol=5.04g,
答:40mL2mol/L的HNO3溶液中含有HNO3的质量是5.04g.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
1.已知:H2O(l)=H2O (g)△H=+Q1KJ•mol-1
2H2O (g)=2H2(g)+O2(g)△H=+Q2KJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O (l)△H=-Q3KJ•mol-1
则H2和CH4的燃烧热的比值为( )
2H2O (g)=2H2(g)+O2(g)△H=+Q2KJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O (l)△H=-Q3KJ•mol-1
则H2和CH4的燃烧热的比值为( )
| A. | $\frac{2{Q}_{1}+{Q}_{2}}{2{Q}_{3}}$ | B. | $\frac{{Q}_{2}+2{Q}_{1}}{2{Q}_{3}}$ | ||
| C. | $\frac{{Q}_{1}-2{Q}_{2}}{{Q}_{3}-2{Q}_{1}}$ | D. | $\frac{{Q}_{1}+{Q}_{2}}{2{Q}_{1}+{Q}_{3}}$ |
2.向100mL pH=l的H2SO4溶液中,滴加0.01mol/L的NaOH溶液,当所得混合液的pH为2时,加入NaOH溶液的体积是( )
| A. | 10 mL | B. | 90 mL | C. | 100 mL | D. | 450 mL |
19.对下列实验过程的评价,正确的是( )
| A. | 某溶液中加入稀盐酸,产生无色气体,证明该溶液中一定有CO32- | |
| B. | 某溶液中先加少量氯化钡溶液,再加足量稀盐酸生成白色沉淀,证明该溶液中一定含有SO42- | |
| C. | 验证烧碱溶液中是否有Cl-,先加稀硝酸除去OH-,再加AgNO3溶液,有白色沉淀产生,证明有Cl- | |
| D. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
16. 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl- | |
| B. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| C. | d点对应的溶液中:F-、NO3-、Fe2+、Na+ | |
| D. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
3.关于下列装置说法正确的是( )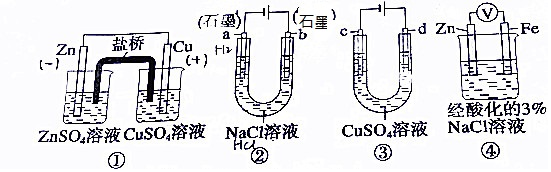

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀 |
11.水蒸气通过炽热的炭层时,发生反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO,该反应类型属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
12.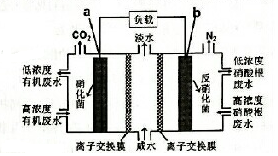 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )| A. | a电极为该电池的正极 | |
| B. | 电极b的反应式:2NO3--10e-+12H+=N2↑+6H2O | |
| C. | 每处理1molC8H10O5,b电极将产生3.2molN2 | |
| D. | a电极离子交换膜允许Na+白中间空迁有机废水处理室 |