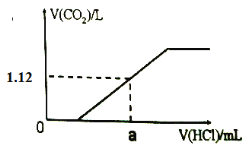
��Ŀ����
����Ŀ��A��B��C��X��Ϊ��ѧ���������ʣ�һ�����������ǵ�ת����ϵ���£�����������ȥ����
A![]() B
B![]() C
C
�Իش�
��1����XΪO2����A��������_____����ѡ���
a��Si b��NH3c��Mg d��S
��2����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��XΪCO2�������ӷ���ʽ����B��Һ�Լ��Ե�ԭ��__________���ٳ�C��һ����;__________��
��3����A��һ�ֻ���ɫ���嵥�ʣ�X��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬��Ӧ�������û���Ӧ��д����Ӧ���Ļ�ѧ����ʽ___________��C��ˮ��Һ�и�����Ũ���ɴ�С˳��Ϊ___________��
���𰸡�a��c CO32��+H2O![]() HCO3��+OH�� �Ʒ��ͷۻ�����θ������ 3Cl2+2NH3=N2+6HCl c(Cl��)��c(NH4+)��c(H+)��c(OH��)
HCO3��+OH�� �Ʒ��ͷۻ�����θ������ 3Cl2+2NH3=N2+6HCl c(Cl��)��c(NH4+)��c(H+)��c(OH��)
��������
��1��a.Si��O2������Ӧ�γ�SiO2��SiO2������������������Ӧ���������⣻
b. NH3��O2�ڴ�������ʱ����������Ӧ����NO��NO��O2��Ӧ����NO2������ʵ�����ʵ��ת�������������⣻
c��Mg��O2��Ӧ����MgO��MgO�����ٱ������������������⣻
d��S�������ٵ�ȼʱ����ΪSO2��SO2������������Ӧ����SO3������ʵ������֮����ת�������������⡣
��ѡ����ac��
��2����A��B��C��ˮ��Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��˵������NaԪ�ء�XΪCO2����A��NaOH��B��Na2CO3��C��NaHCO3��Na2CO3��ǿ�������Σ�����Һ��CO32-����ˮ�ⷴӦ������ˮ���������H+���ٽ���ˮ�ĵ���ƽ�������ķ����ƶ��������մﵽƽ��ʱ��c(OH-)��c(H+)��������Һ�Լ��ԣ������ӷ���ʽ����B��Һ�Լ��Ե�ԭ��CO32��+H2O![]() HCO3��+OH����NaHCO3�׳�С�մ�����������θ����࣬��ĭ���������ȡ���ɵ�ʳƷ�ȡ�
HCO3��+OH����NaHCO3�׳�С�մ�����������θ����࣬��ĭ���������ȡ���ɵ�ʳƷ�ȡ�
��3����A��һ�ֻ���ɫ���嵥�ʣ���A��Cl2��X��һ����ʹʪ��ĺ�ɫʯ����ֽ���������壬X��NH3����Ӧ�������û���Ӧ��,�÷�Ӧ�Ļ�ѧ����ʽ3Cl2+2NH3=N2+6HCl ������ͨ�백����������Ӧ����NH4Cl.������ǿ�������Σ�����Һ��NH4+ˮ������ˮ���������OH-���ٽ���ˮ�ĵ���ƽ�⣬���մﵽƽ��ʱ����Һ��c(H+)��c(OH-)��NH4+ˮ�����ģ�����c(Cl-)��c(NH4+)��������ˮ��̶������ģ��ε������������Ũ��Զ����ˮ����������ӵ�Ũ�ȣ�����c(NH4+)��c(H+)����C��ˮ��Һ�и�����Ũ���ɴ�С˳��Ϊc(Cl��)��c(NH4+)��c(H+)��c(OH��)��

 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�