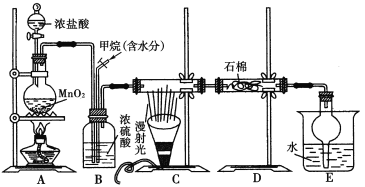
题目内容
【题目】某种半水煤气中主要含![]() 、CO、
、CO、![]() 、
、![]() 和少量
和少量![]() ,经“脱硫”、转换反应可制得合成氨原料气。
,经“脱硫”、转换反应可制得合成氨原料气。
(1)这种半水煤气跟空气按一定比例混合后通入![]() 、
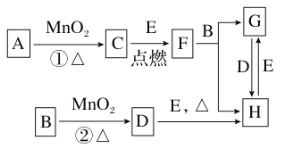
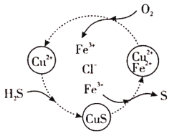
、![]() 的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为
的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为![]() ,该转化过程中起催化作用的离子为____,写出该过程中属于非氧化还原反应的离子方程式___。
,该转化过程中起催化作用的离子为____,写出该过程中属于非氧化还原反应的离子方程式___。
(2)脱硫后的半水煤气与水蒸气以1:15比例混合后通入转换塔中,变换反应为:![]() 。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
第一步:![]()
![]() (慢反应)
(慢反应)
第二步:![]()
![]() (快反应)
(快反应)
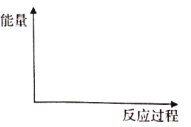
①在下图中绘制变换反应(经上述催化反应过程)的“能量~反应过程”示意图___。
②由于![]() 和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是____。
和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是____。
(3)半水煤气处理后得到的混合气中,可通过在熔融碳酸盐中经电化学还原消除其中的二氧化碳,并得到高纯度的碳,写出生成碳的电极反应式为____。
【答案】![]() 、
、![]()
![]()
 第一步反应慢,第二步反应快,生成铁会快速转化为
第一步反应慢,第二步反应快,生成铁会快速转化为![]() ;生产中只要保持体系中有较高浓度水蒸气,铁就不能在体系大量存在
;生产中只要保持体系中有较高浓度水蒸气,铁就不能在体系大量存在 ![]()
【解析】
(1)根据流程图可知,铜离子和亚铁离子参与了反应,又在反应最后重新生成,根据没有发生化合价改变的部分,写出非氧化还原方程式;
(2)①根据热化学方程式,画出能量相关图像;
②根据外界条件对反应速率和平衡状态的影响分析;
(3)根据电解质成分为熔融碳酸盐,推断出产物中有碳酸根,根据得失电子写出电极反应方程式。
(1)根据流程图,铜离子和亚铁离子参与了反应,又在反应最后重新生成,符合催化剂的性质,在流程图中发现铜离子的化合价没有发生改变,所以属于非氧化还原方程式为![]() ;
;
(2)①根据热化学方程式,由于第一个反应反应较慢,可以推测出该反应所需的活化能多,反应快的反应需要的活化能少,再根据焓变,画出图像为 ;
;
②根据热化学方程式的反应快慢,推测出反应过程中,生成四氧化三铁的速率快,只要满足生成四氧化三铁的水蒸气的量,就可以避免生成铁,从而防止使催化剂失活,因此原因是第一步反应慢,第二步反应快,生成铁会快速转化为![]() ,同时生产中只要保持体系中有较高浓度水蒸气,铁就不能在体系大量存在;
,同时生产中只要保持体系中有较高浓度水蒸气,铁就不能在体系大量存在;
(3)根据电解质成分为熔融碳酸盐,同时得到高纯度的碳,判断是二氧化碳在正极得电子的反应,电极反应方程式为![]() 。
。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
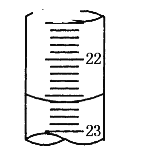
(1)滴定终点时的现象为锥形瓶中的溶液由______;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_______;
(3)该小组在步骤①中的错误是______,由此造成的测定结果________(填“偏高”或“偏低”或“无影响”);
(4)步骤②缺少的操作是_____;
(5)如上图是某次滴定时的滴定管中的液面,其读数为___mL;
(6)根据下列数据:
测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
第一次 | 25.00 | 0.40 | 20.38 |
第二次 | 25.00 | 4.00 | 24.02 |
请计算待测烧碱溶液的物质的量浓度。(请写出解答过程)_______________