题目内容
11.由乙醛、乙醇、丁醇三种物质组成的混合物0.1mol,完全燃烧后,将所得气体先通过浓硫酸,然后再通过盛有碱石灰的干燥管,测得浓硫酸的质量增加了5.4克.则原混合物中乙醛、乙醇、丁醇的物质的量之比为( )| A. | 2:3:1 | B. | 1:2:3 | C. | 4:3:2 | D. | 3:2:1 |
分析 浓硫酸增重的为水的质量,根据n=$\frac{m}{M}$计算出5.4g水的物质的量,从而可根据质量守恒定律计算出混合物中平均H原子数,然后结合三者分子组成可知,乙醇的含量不影响混合物组成,则只要乙醛和丁醇的平均H原子数为6即可,据此进行解答.
解答 解:乙醛、乙醇、丁醇的分子式分别为C2H4O、C2H6O、C4H10O,浓硫酸增重的为水的质量,其物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol,说明0.1mol混合物中含有0.6molH,则混合物中含有的平均H原子数为:$\frac{0.6mol}{0.1mol}$=6,由于乙醇分子中含有6个H原子,其含量不影响混合物组成,则只要乙醛和丁醇的平均H原子数为6即可,
设乙醛的物质的量为x,丁醇的物质的量为y,则$\frac{4x+10y}{x+y}$=6,整理可得:x:y=2:1,
即:只要乙醛和丁醇的物质的量之比为2:1即可,满足条件的为AC,
故选AC.
点评 本题考查了混合物反应的计算,题目难度中等,根据题干数据计算出混合物中平均H原子数为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
1. 如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
 如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
如图两个电解槽中,a、b、c、d均为石墨电极.若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )| A. | 甲烧杯中a极上最多可析出铜0.64g | |
| B. | 甲烧杯中b极上电极反应式4OH--4e-═2H2O+O2↑ | |
| C. | 乙烧杯中滴入酚酞试液,d极附近先变红 | |
| D. | 烧杯中c极上电极反应式为4H++4e-═2H2↑ |
2.下列有关试剂的保存方法正确的是( )
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中.
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
19.某一元醛发生银镜反应,生成金属银4.32g,等量该醛完全燃烧后,可生成水1.08g,则此醛可以是下列中的( )
| A. | 丙醛(CH3CH2CHO) | B. | 丙烯醛(CH2=CH-CHO) | ||
| C. | 丁醛(C3H7CHO) | D. | 丁烯醛(CH3-CH=CH-CHO) |
3.X、Y是浓度均为0.1mol/L的溶液中的某一种:①混有少量盐酸的MgSO4溶液 ②Al2(SO4)3溶液 ③明矾溶液 ④Ba(OH)2溶液 ⑤NaOH溶液.现向溶液X中逐滴加入溶液Y.得到的沉淀量与所加Y溶液的体积的关系的部分图象如图所示.则符合该图象的X、Y的组合共有( )

| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
20.下列反应的离子方程式书写正确的是( )
| A. | 向NaOH溶液中通入少量CO2:OH-+CO2═HCO3- | |
| B. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | Al(NO3)2溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═Fe2++S↓+2H+ |
1.已知2Fe2++Br2═2Fe3++2Br-,在含有a mol FeBr2溶液中通入b mol Cl2,当a:b=1时,溶液中发生反应的离子方程式为( )
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Fe2++Br2═Fe3++Br- |
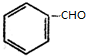 +H2(足量):
+H2(足量):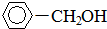 .
.