题目内容
 某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO1000mL、密度1.19g?cm-3.
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO1000mL、密度1.19g?cm-3.请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为
(2)某实验需用480mL含25%NaClO的消毒液.该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液.
①下列说法正确的是
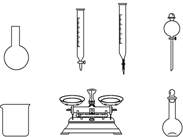
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用久置的NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据含25%NaClO、1000mL、密度1.19g?cm-3,及根据c=
来计算;
(2)①根据溶液的配制及c=
、m=nM来分析;
②根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断.
| 1000ρw |
| M |
(2)①根据溶液的配制及c=
| n |
| V |
②根据c=
| n |
| V |
解答:
解:(1)根据c=
,则c(NaClO)=
=4.0 mol?L-1,故答案为:4.0;
(2)①A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以久置的NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol?L-1×74.5 g?mol-1=149 g,故D错误;
故答案为:C;
②A.未洗涤烧杯,使n偏小,浓度偏小,故A错误;
B.俯视刻度线,使V偏小,浓度偏大,故B正确;
C.仰视刻度线,使V偏大,浓度偏小,故C错误;
D.少量液体溅出,使n偏小,浓度偏小,故D错误.
故答案为:B.
| 1000ρw |
| M |
| 1000mL×1.19g?cm -3×25% |
| 74.5g?mol-1×1L |
(2)①A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以久置的NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol?L-1×74.5 g?mol-1=149 g,故D错误;
故答案为:C;
②A.未洗涤烧杯,使n偏小,浓度偏小,故A错误;
B.俯视刻度线,使V偏小,浓度偏大,故B正确;
C.仰视刻度线,使V偏大,浓度偏小,故C错误;
D.少量液体溅出,使n偏小,浓度偏小,故D错误.
故答案为:B.
点评:本题考查有关物质的量浓度的计算,明确浓度、体积、物质的量的关系及溶液配制的仪器、步骤等即可解答,难度不是很大,但计算较繁琐.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列说法正确的是( )
| A、金属晶体具有良好的延展性,是因为金属晶体中的原子层在滑动过程中金属键未破坏 |
| B、电子云图象中黑点的疏密是指电子数的多少 |
| C、含有极性键的分子一定是极性分子 |
| D、键能越大,表示该分子越容易受热分解 |
0.01mol氯化铬(CrCl3?6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀则此配合物可能是( )
| A、[Cr(H2O)6]Cl3 |
| B、[Cr(H2O)5Cl]Cl2 |
| C、[Cr(H2O)4Cl2]Cl |
| D、[Cr(H2O)3Cl3] |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Na+、H+、SO42-、OH- |
| B、K+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、Cu2+、Cl-、SO42- |
下列物质加入水中得到的水溶液能导电,但本身属于非电解质的是( )
| A、HNO3 |
| B、Cl2 |
| C、SO2 |
| D、Na2O |