题目内容
下列各组中的离子,能在溶液中大量共存的是( )
| A、H+、Na+、CO32-、Cl- |
| B、Ba2+、Na+、Cl-、SO42- |
| C、K+、H+、SO42-、OH- |
| D、Ag+、K+、NO3-、H+ |
考点:离子共存问题
专题:离子反应专题
分析:离子之间如果不结合生成气体、沉淀、弱电解质、络合物,不能发生氧化还原反应等,则离子能大量共存,以此来解答.
解答:
解:A.酸性条件下,碳酸根离子和氢离子反应生成二氧化碳和水,所以不能共存,故A错误;
B.硫酸根离子和钡离子反应生成硫酸钡白色沉淀,所以不能共存,故B错误;
C.氢氧根离子和氢离子反应生成水,所以不能大量共存,故C错误;
D.这几种离子之间不能结合生成气体、沉淀、弱电解质、络合物,不能发生氧化还原反应等,所以能共存,故D正确;
故选D.
B.硫酸根离子和钡离子反应生成硫酸钡白色沉淀,所以不能共存,故B错误;
C.氢氧根离子和氢离子反应生成水,所以不能大量共存,故C错误;
D.这几种离子之间不能结合生成气体、沉淀、弱电解质、络合物,不能发生氧化还原反应等,所以能共存,故D正确;
故选D.
点评:本题考查了离子共存,明确离子共存的条件是解本题关键,注意题目中隐含条件,为易错点.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
某电池示意图如图,该电池工作时,下列说法正确的是( )


| A、铜作正极,发生氧化反应 |
| B、外电路中电子的移动方向为Fe→Cu |
| C、Fe电极的电极反应式为Fe-3e-═Fe3+ |
| D、盐桥中Cl-向正极移动 |
下列离子方程式书写正确的是( )
| A、铜片跟稀硝酸反应:Cu+4H++NO3-═Cu2++NO↑+2H2O |
| B、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| C、FeBr2溶液与等物质的量Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
| D、向小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)下列叙述正确的是( )
| A、达到化学平衡时,4v正(O2)=5v逆(NO) |
| B、若单位时间内生成x mol NO,同时消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若缩小容器体积,则正反应速率减少,逆反应速率增大 |
| D、在恒容容器中,若混合气体密度不再改变,则反应达到平衡状态 |
下列离子方程式书写正确的是( )
| A、氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| B、Al2O3溶于盐酸中:O2-+2H+=H2O |
| C、氯化铝溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| D、氯气与水反应 Cl2+H2O?H++Cl-+HClO |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1L0.1mol?L-1乙酸溶液中H+数为0.1NA |
| B、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C、室温下,21.0g乙烯和丙烯的混合气体中含有的碳原子数目为1.5NA |
| D、22.4L的CO气体与lmol N2所含的电子数相等 |
室温下,各离子组一定能大量共存的是( )
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、pH=0的溶液中:Na+、Fe3+、NO3-、SO42- |
| C、含有1mol?L-1Fe3+的溶液中:K+、Mg2+、I-、NO3 |
| D、由水电离的c(H+)=1×10-14的溶液中:K+、Ca2+、Cl-、HCO3 |
下列化学用语或模型表示不正确的是( )
| A、中子数为14的硅原子:1428Si |
B、CH4分子的比例模型 |
C、聚乙烯的结构简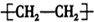 |
| D、次氯酸分子的结构式:H-O-Cl |