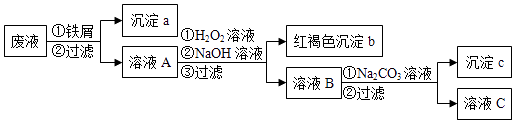
题目内容
【题目】将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为amolL﹣1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干并充分灼烧得到固体W2g.下列关系式中错误的是( )
A.24n(Al)+35.5n(Na)=W2﹣W1
B.n(Na)+3n(Al)=aV2
C.n(Na)+3n(Al)= ![]()
D.aV2= ![]()
【答案】D
【解析】解:将质量为W1g的钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3 , 将溶液蒸干并充分灼烧得到固体W2g,在蒸干并灼烧过程中发生反应为
AlCl3+3H2O═Al(OH)3+3HCl,2Al(OH)3 ![]() Al2O3+3H2O,最后得到的固体为NaCl和Al2O3 ,
Al2O3+3H2O,最后得到的固体为NaCl和Al2O3 ,
A、根据以上分析可知,最后得到的固体为NaCl和Al2O3 , 根据物质的组成可知W2﹣W1=m(Cl)+m(O)=35.5n(Na)+ ![]() ×n(Al)×16=35.5n(Na)+24n(Al),故A正确;
×n(Al)×16=35.5n(Na)+24n(Al),故A正确;
B、向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3 , 共消耗盐酸为aV2mol,
根据NaCl和AlCl3的化学式可知n(Na)+3n(Al)=aV2 , 故B正确;
C、将钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知
1molNa~0.5molH2~1molH,1molAl~1.5molH2~3molH,生成H2的物质的量为 ![]() ,共含有
,共含有 ![]() molH,所以n(Na)+3n(Al)=
molH,所以n(Na)+3n(Al)= ![]() ,故C正确;
,故C正确;
D、由B解可知n(Na)+3n(Al)=aV2 , 由C解可知n(Na)+3n(Al)= ![]() ,则aV2=
,则aV2= ![]() ,故D错误.
,故D错误.
故选D.
将质量为W1g的钠、铝混合物投入一定量的水中充分反应,反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
向溶液中加入盐酸至过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时,溶液成分是NaCl和AlCl3 , 将溶液蒸干并充分灼烧得到固体W2g,在蒸干并灼烧过程中发生反应为
AlCl3+3H2O═Al(OH)3+3HCl,2Al(OH)3 ![]() Al2O3+3H2O,最后得到的固体为NaCl和Al2O3 , 以此进行计算.
Al2O3+3H2O,最后得到的固体为NaCl和Al2O3 , 以此进行计算.

 备战中考寒假系列答案
备战中考寒假系列答案